
【题目】海带中含有碘元素。某实验小组设计了如下实验流程,通过实验证明海带中存在碘元素,并从海带中提取出碘单质。

根据实验流程回答下列各题:
(1)步骤①中灼烧所用到硅酸盐材质的仪器,除酒精灯外还有______。
(2)步骤③的操作名称为______。
(3)经过步骤③以后,所得滤液中主要含有可溶性的无机盐:氯化钠、硫酸钠、碘化钠等。为了将I-变为碘单质,可加入经硫酸酸化的双氧水氧化,写出该反应的离子方程式______。检验步骤④是否成功的方法是______。
(4)步骤⑤操作名称是______。
(5)为了进一步制得纯净的碘单质,可以通过步骤⑥实现,实验装置如下图所示。

已知实验中得到的粗碘为碘的CCl4溶液,CCl4的沸点76.8℃、I2的沸点184.4℃。
①指出图中错误的地方并改正______。
②锥形瓶中先收集到的物质是______。
【答案】坩埚、泥三角过滤2I-+2H++H2O2=2H2O+I2取少量溶液加入淀粉,看溶液是否变蓝萃取和分液蒸馏烧瓶加热时应垫石棉网,温度计水银球应该在支管口附近,冷凝水应该下进上出CCl4
【解析】
(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,所以还缺少硅酸盐材质的仪器为坩埚、泥三角;
(2)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,即步骤③的操作名称为过滤;
(3)含碘离子溶液中加入氧化剂双氧水是为了将碘离子氧化成单质碘,离子方程式为2I-+2H++H2O2=2H2O+I2;碘遇淀粉显蓝色,所以检验步骤④是否成功的方法是取少量溶液加入淀粉,看溶液是否变蓝,如果变蓝,说明还有单质碘;
(4)利用碘易溶于有机溶剂的性质来进行提取,所以步骤⑤操作名称是萃取和分液;
(5)①根据装置图可知蒸馏烧瓶加热时应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,冷凝管冷凝水应该是下进上出;
②由于四氯化碳的沸点低于碘,所以锥形瓶中先收集到的物质是CCl4。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是

A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法,可以表明反应N2 + 3H2![]() 2NH3已达到平衡的标志是
2NH3已达到平衡的标志是
A. 1molN≡N键断裂的同时,有6molN-H键形成
B. 1molN≡N键断裂的同时,有3molH-H键断裂
C. 1molN≡N键断裂的同时,有3molH-H键形成
D. 1molN≡N键断裂的同时,有2molN-H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一些微粒:①D2O ②H2O ③O2 ④O3 ⑤12C ⑥14C (填序号,下同).其中互为同位素的是 . 互为同素异形体的是 . 属于同种物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。肼燃料电池原理如图所示,通入氧气的电极上发生的电极反应式为____________________。

(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。

④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛被认为是现今世界上性能最好的一种白色颜料。同时它有较好的紫外线掩蔽作用,超细的二氧化钛粉末也被加入到防晒膏中制成防晒化妆品。现在某实验小组按照下面的流程来合成纳米二氧化钛。
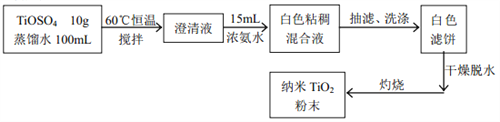
实验机理: TiOSO4+2NH3H2O = TiO(OH)2↓+(NH4)2SO4
信息提示:①钛元素化合物的性质和铝有一定的相似性。TiO2具有两性,Ti(OH)4不稳定,容易失去一分子水形成TiO(OH)2。
②钛的原子量: 48
③浓氨水的密度:0.91g cm-3
(1)灼烧时用到的硅酸盐容器是_______。
(2)下列说法正确的是_______。
A. 为了加快反应速率,可以用氢氧化钠溶液代替浓氨水
B. 为了提高产率,反应容器需要用滤液洗
C. 为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸
D. 为了加快干燥的速率,干燥时可以用小火加热
E. 灼烧后需要冷却到室温,称量一次所得数值即为 TiO2的质量
(3)为了使实验过程中尽可能的减少环境污染,同时要注意操作的安全性, 请你指出该反应装置图中的需要改进之处(指出两处即可)_____________。
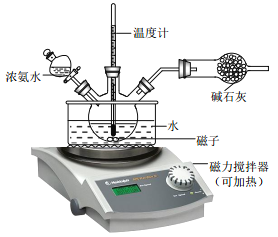
(4)反应后的白色粘稠混合液经过抽滤、洗涤可以得到白色滤饼。如何证明白色滤饼已经洗干净了呢?_____。
(5)焙烧后有时会有少量的TiO2残留在容器中无法去除,我们可以用NaOH溶液将残留的TiO2洗干净。请你用化学方程式表示该洗涤原理___________。
(6)最后称得纳米 TiO2 的质量是a 克,请你计算用该方法制备 TiO2的产率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。
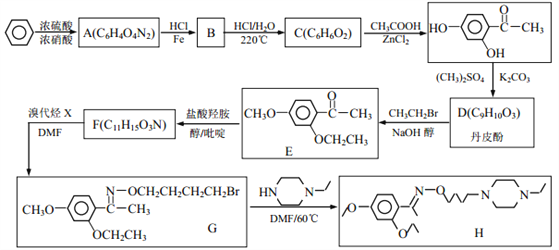
已知:①![]()
②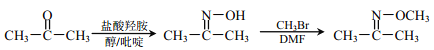
③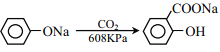
请回答:
(1)E中含有的官能团名称为_________;
(2)丹皮酚的结构简式为_________;
(3)下列说法不正确的是(___)
A.乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B.物质B 可能溶于水,且能与盐酸反应生成有机盐
C. D→E 和 G→H 的反应类型均为取代反应
D.物质 C 能使浓溴水褪色,而且 1mol C 消耗 2molBr2
(4)写出 F→G 的化学方程式_________。
(5)写出满足下列条件 F 的所有同分异构体的结构简式_________。
①能发生银镜反应;1molF 与 2molNaOH恰好反应。
②1H-NMR 谱显示分子中含有 5 种氢原子; IR 谱显示有-NH2,且与苯环直接相连。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林(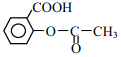 )。(用流程图表示,无机试剂任选)______。
)。(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
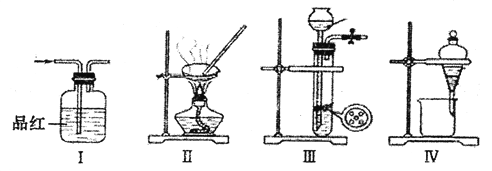
A. 将装置I中通入C12和SO2的混合气体,然后加热褪色后的溶液,据溶液是否变红来证明SO2的是否存在
B. 用装置Ⅱ来蒸发浓缩CuSO4溶液,并通过冷却结晶、过滤的方法获得胆矾晶体
C. 用浓氨水和块状固体NaOH在装置III中作用,来快速制取NH3
D. 用装置IV来分离乙醇萃取碘水后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com