
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
【答案】C
【解析】
A、依据元素周期律,硅的还原性大于碳,上述反应能发生是因为产物中有CO气体生成,使平衡向右移动,故A错误;
B、磨口玻璃塞中玻璃成分二氧化硅能和氢氧化钠反应,生成具有粘性的硅酸钠,造成玻璃塞和瓶体粘在一起,不便于打开,所以盛放氢氧化钠溶液时,不可以用玻璃瓶塞,故B错误;
C、二氧化硅难溶于水,所以无法用二氧化硅和水直接反应制得,用SiO2制取硅酸,先使二氧化硅与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O,因碳酸酸性强于硅酸且硅酸溶解度较小的沉淀,所以通入CO2,发生Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,制得硅酸,故C正确;
D、反应不是在水溶液中进行的,且产物中有气体生成,与酸性强弱无关,一般在溶液中强酸可制得弱酸,即硅酸钠溶液中通入CO2,制得硅酸说明碳酸酸性强于硅酸,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之向的关系如图所示。则下列说法正确的是( )
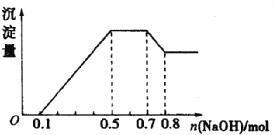
A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中c(NH4+)=0.2mol/L
C. 溶液中一定不含CO32-和NO3-,一定含有SO42-
D. c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表中元素分布的描述,正确的是
A. 周期表中的主族都有非金属元素
B. 周期表中的主族都有金属元素
C. 周期表中的金属元素都位于长周期
D. 周期表中的非金属元素都位于主族和0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
Ⅰ.常温下向100mL0.2mol·L-l的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体枳的关系如图所示,根据图象回答下列问题。
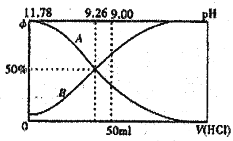
(1)表示NH3·H2O浓度变化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的电离常数为____________(已知lg1.8=0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用数字表示精确值)。
Ⅱ.若液氨中也存在类似水的电离(H2O+H2O![]() H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式__________________________。
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式____________________________________。
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
A. 若XY2是共价化合物,则X与Y的原子序数可能相差1
B. 若XY2是离子化合物,则X与Y的原子序数可能相差8
C. 若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小
D. 若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种晶体的晶胞如图所示;所示晶胞从左到右分别表示的物质是
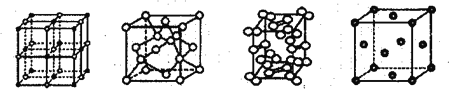
A. 碘、铜、氯化钠、金刚石 B. 氯化钠、金刚石、碘、铜
C. 氯化钠、铜、碘、金刚石 D. 铜、氯化钠碘、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示不正确的是
A. 氢离子结构示意图:![]() B. 中子数为20 的Ar原子:
B. 中子数为20 的Ar原子:![]()
C. 二氧化硅的结构式:O=Si=O D. 乙烯的结构简式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
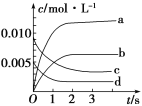
(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com