
【题目】下列化学用语表示不正确的是
A. 氢离子结构示意图:![]() B. 中子数为20 的Ar原子:
B. 中子数为20 的Ar原子:![]()
C. 二氧化硅的结构式:O=Si=O D. 乙烯的结构简式:CH2=CH2
【答案】C
【解析】
A项,氢原子核内只有1个质子,核外只有1个电子;
B项,原子表示符号![]() 中,Z表示质子数、A表示质量数,质量数=质子数+中子数;
中,Z表示质子数、A表示质量数,质量数=质子数+中子数;
C项,二氧化硅是原子晶体,不存在硅氧双键;
D项,结构简式是把结构式中的单键省略之后的一种简略表达形式,应表现该物质中的官能团,只要把碳氢单键省略掉即可。以此分析解决。
A项,氢原子失去核外的一个电子变为氢离子,氢离子结构示意图为:![]() ,故A正确;
,故A正确;
B项,Ar的质子数为18,则中子数为20的Ar原子质量数为38,可表示为:![]() ,故B正确;
,故B正确;
C项,二氧化硅为原子晶体,1个硅原子形成4个硅氧键,1个氧原子形成2个硅氧键,所以二氧化硅中不存在硅氧双键,故C错误;
D项,乙烯分子式为C2H4,分子中存在碳碳双键,结构简式为:CH2=CH2,故D正确。
综上所述,符合题意的选项为C。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质)写出试剂或操作的名称、方法及有关的化学方程式或离子方程式:
(1)Fe2O3(Al2O3)_________________;离子方程式__________。
(2)Fe2O3[Fe(OH)3]________;化学方程式_______________。
(3)FeSO4溶液(CuSO4)_____________;离子方程式_________。
(4)FeCl3溶液(FeCl2)_____________;离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
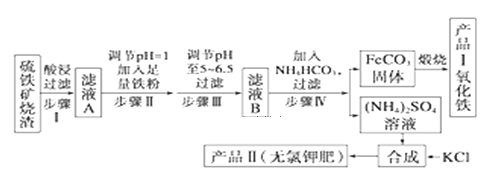
回答下列问题:
(1))古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母) a.Fe b.FeO c.Fe2O3 d.Fe3O4
(2)酸浸、过滤后滤液A中的金属阳离子是_________,检验其中较低价态的阳离子所用试剂为________(填化学式)。煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 _____、趁热过滤、洗涤、干燥.
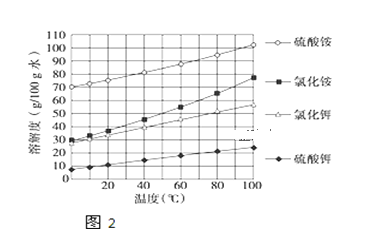
(4)进一步提纯产品Ⅱ的方法是;__________________
(5)步骤IV反应的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃是( )
A. 含有C、H元素的有机物 B. 含有C元素的化合物
C. 仅由C、H两种元素组成的有机物 D. 完全燃烧只生成CO2和H2O的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍、铂、镧等过渡金属单质及化合物在医疗等领域有广泛的应用。
(1)基态镍原子的价电子排布式为__________。
(2)抗癌药奥钞利铂(又名乙二酸铂)的结构简武如图所示。
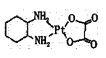
①分子中氮原子杂化轨道类型是______,C、N、O三种元素的第一电离能由大到小的顺序为________。
②1mol乙二酸分子中含有σ键的数目为_____NA。
(3)碳酸澜[La2(CO3)3]可用于治疔高磷血症。
①写出与CO32-互为等电子体的一种分子的化学式________。
②镧镍合金可用于储氢,储氢后晶体的化学式为LaNi5(H2)3,最小重复结构单元如图所示(![]() 、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。
、O、●代表晶体中的三种微粒),则图中●代表的微粒是_______(填微粒符号)。

(4)用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。
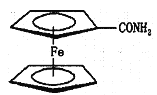
①巳知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁平酰胺晶体为______晶体。
②二茂铁甲酰胺中存在的化学键_________。
③碳氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下NH3的沸点比CH4的沸点高,主要原因是______________。
(5)铝镍合金的晶胞如图所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数,则晶胞中镍、铝原子的最短核间距(d)为_______pm。
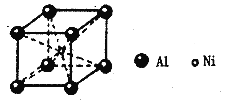
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在强碱性溶液中可以大量共存的离子组是( )
A.K+、 Cu2+、SO32-、MnO4-B.NH4+、Fe2+、NO3-、H+
C.HCO3-、Na+ 、Mg2+、Cl-D.Na+、K+、SO42-、 NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com