
【题目】(1)根据下列图示,写出反应的热化学方程式。

A.___________________________________。
B.___________________________________。
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式为___________________。
(3)如图是598 K时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________。
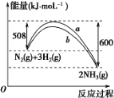
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol1CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol1S(s)+O2(g)=SO2(g) ΔH=296.8 kJ·mol1N2(g)+3H2(g)![]() 2NH3(g) ΔH=92 kJ·mol1
2NH3(g) ΔH=92 kJ·mol1
【解析】
(1)根据图像可知A图中反应物总能量高于生成物总能量,是放热反应,反应热是41 kJ·mol1,B图中反应物总能量低于生成物总能量,是吸热反应,反应热是+41 kJ·mol1,因此热化学方程分别为:
A、CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol1;
B、CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol1;
(2)16 g固体硫的物质的量是0.5mol,完全燃烧时放出148.4 kJ的热量,则1mol固体硫完全燃烧时放出2×148.4 kJ=296.8 kJ的热量,因此该反应的热化学方程式为S(s)+O2(g)=SO2(g) ΔH=296.8 kJ·mol1。
(3)根据图像可知反应物总能量高于生成物总能量,是放热反应,反应热ΔH=508 kJ/mol-600 kJ/mol=-92 kJ/mol,因此该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92 kJ·mol1。
2NH3(g) ΔH=92 kJ·mol1。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如下图所示的转化关系,下列判断错误的是

A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则Z可能是NaAlO2
B. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
C. 若图中反应均为非氧化还原反应,当W为一元强酸时则X可能是NH3
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,A与B反应可生成C和D,其能量变化如图:

(1)下列有关反应A+B=C+D的说法正确的是________。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需要加热反应就一定能自发进行
D.反应物的总质量、总能量与反应产物的总质量、总能量均相等
(2)若E1<E2,则反应产物的总能量________(填“>”“<”或“=”)反应物的总能量,反应热Q________0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 0.1 mol![]() 所含电子的数目为1.4NA
所含电子的数目为1.4NA
B. 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 14gLi在空气中充分燃烧,消耗氧分子的数目为NA
D. 标准状况下,11.2LCl2溶于水,溶液中Clˉ、ClOˉ和HClO的微粒数之和小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A. 砷元素的最高化合价为+3价
B. 砷原子的第三电子层含有8个电子
C. 砷元素是第四周期的主族元素
D. 砷的氧化物的水溶液呈强碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有① SiO2② Na2CO3③ (NH4)2CO3④ Al(OH)3四种物质,其中既能与盐酸反应,又能与NaOH溶液反应的是( )
A. ① ② B. ② ④ C. ③ ④ D. ① ② ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1molH-H键消耗能量E1,拆开1molO=O键消耗能量E2,结合1molH-O键放出能量E3,对于氢气燃烧生成水的反应的能量变化描述,下列各项正确的是( )
A. 2E1+E2>2E3B. 2E1+E2<4E3C. 2E1+E2>4E3D. 2E1+E2<2E3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是
容器 | 温度 | N2(mol) | H2(mol) | 催化剂 |
A | 500 | 2 | 6 | 有 |
B | 500 | 1.5 | 4.5 | 无 |
C | 450 | 1.5 | 4.5 | 无 |
D | 450 | 2 | 6 | 无 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com