
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
【答案】适当升高温度、适当提高稀硫酸的浓度 (NH4)2SO4 1.46×10-6molL-1 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成,则洗涤干净 防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥 2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42—+14H2O
【解析】
试题本题以软锰矿和黄铁矿为主要原料制备MnCO3的流程为载体,考查流程的分析,反应条件的控制,溶度积的计算,离子方程式的书写,基本实验操作,离子方程式的配平。软锰矿和黄铁矿用稀硫酸溶浸后软锰矿中的MnO2主要转化为MnSO4,黄铁矿中FeS2主要转化为Fe2(SO4)3;溶浸过程中FeS2可能转化为FeSO4,溶浸后的溶液中加入MnO2将Fe2+氧化成Fe3+,加入石灰调节pH使Fe3+完全转化为Fe(OH)3沉淀除去;净化工序中加入(NH4)2S除去Cu2+,加入NH4F除去Ca2+;沉锰过程即向MnSO4溶液中加入NH4HCO3、氨水形成MnCO3,过滤后的废液中含大量的NH4+、SO42-。
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎外,还可以采取的措施有:适当升高温度、适当提高稀硫酸的浓度。
(2)沉锰过滤后的废液中含大量的NH4+、SO42-,副产品A的化学式为(NH4)2SO4。
(3)CaF2的溶解平衡表达式为CaF2(s)![]() Ca2+(aq)+2F-(aq),Ksp(CaF2)=c(Ca2+)·c2(F-),若滤液中c(F-)=0.01mol/L,则滤液中残留的c(Ca2+)= Ksp(CaF2)
Ca2+(aq)+2F-(aq),Ksp(CaF2)=c(Ca2+)·c2(F-),若滤液中c(F-)=0.01mol/L,则滤液中残留的c(Ca2+)= Ksp(CaF2)![]() c2(F-)=1.46
c2(F-)=1.46![]() 10-10
10-10![]() (0.01)2=1.46
(0.01)2=1.46![]() 10-6mol/L。
10-6mol/L。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,Mn2+与HCO3-电离产生的CO32-形成MnCO3沉淀,促进HCO3-进一步电离产生H+,H+与另一部分HCO3-生成H2O和CO2,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑。沉锰工序中要判断沉淀已经洗涤干净即检验最后洗涤液中不含(NH4)2SO4,沉锰工序中判断沉淀已经洗涤干净的实验操作是:取最后一次洗涤液少许,加入几滴BaCl2溶液,若无白色沉淀生成,则洗涤干净。
(5)MnCO3潮湿时易被空气氧化,100℃MnCO3开始分解,工业上用少量C2H5OH洗涤的原因是:防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥(乙醇的沸点低于100℃)。
(6)在反应中FeS2中Fe元素的化合价由+2价升至+3价,S元素的化合价由-1价升至+6价,1molFeS2失去15mol电子;Mn元素的化合价由+4价降至+2价,1molMnO2得到2mol电子;根据得失电子守恒配平:2FeS2+15MnO2→2Fe3++4SO42-+15Mn2+,在溶浸过程中加入稀硫酸,结合原子守恒和电荷守恒,写出配平的离子方程式为2FeS2+15MnO2+28H+=2Fe3++4SO42-+15Mn2++14H2O。


科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____(填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(2)碘元素可预防甲状腺肿大,因此我国市场上的食盐均加了碘(KIO3)。甲同学鉴别食盐是否加碘的流程如下:
![]()
①若样品为加碘食盐,则现象应为_____,此方法中KI的作用是_____。
②乙同学取纯NaCl作样品做对照实验,也出现了明显的现象,原因是____。
③丙同学提出新的鉴别加碘食盐的方案,流程如下:
![]()
此方案第一步涉及反应的离子方程式为____。
(3)已知反应2HBr(g) = H2(g) + Br2(g) ΔH= +102 kJ·mol-1。
①1molH2(g)、1molBr2(g)分子中化学键断裂时分别需要吸收436kJ、200kJ的能量,则1molHBr(g)分子中化学键断裂时需吸收的能量为___kJ。
②某温度下,向体积为2L的密闭容器中通入amol HBr气体,10min后测得Br2蒸气的浓度为bmol/L,则此段时间内υ(HBr)=____。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。

B→A+C反应的热化学方程式为____(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据下列图示,写出反应的热化学方程式。

A.___________________________________。
B.___________________________________。
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式为___________________。
(3)如图是598 K时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________。
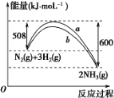
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
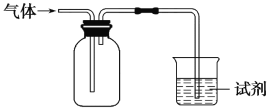
选项 | 气体 | 试剂 | 现象 | 结论 |
A | NO | 紫色石蕊溶液 | 溶液变红 | NO与水反应生成硝酸 |
B | Cl2 | 淀粉KI溶液 | 溶液变蓝 | Cl2有氧化性 |
C | SO2 | 品红溶液 | 溶液褪色 | SO2有强氧化性 |
D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是( )
A.吸带过滤嘴的香烟,对人体无害
B.利用气球内的干冰释放出二氧化碳的原理,使气球始终处于充足了气的状态
C.纯天然物质配成的饮料,不含任何化学物质
D.蒸馏水绝对纯净,其中不含任何离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列转化中,既表现出氧化性又表现出酸性的是 ( )
A. Cu―→CuSO4 B. C―→CO2
C. Fe(OH)3―→Fe2(SO4)3 D. Fe2O3―→Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com