
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |
分析 ①除杂质:NaHCO3溶液(Na2CO3),向混合溶液中通入过量二氧化碳,碳酸钠能转化为碳酸氢钠;
②除杂质:MgO(Al2O3),MgO不溶于强碱溶液,Al2O3能溶于强碱溶液生成可溶性的偏铝酸盐,然后采用过滤方法分离;
③除杂质:FeCl2溶液(FeCl3),氯化铁能和Fe反应生成氯化亚铁,然后采用过滤方法分离;
④鉴别:NaCl、KCl,二者阳离子不同,可以用焰色反应鉴别;
⑤鉴别:AlCl3、Al2(SO4)3溶液,二者区别是阴离子,氯化钡中钡离子能和硫酸根离子反应生成白色沉淀,而氯化铝和氯化钡溶液不反应.
解答 解:①除杂质:NaHCO3溶液(Na2CO3),向混合溶液中通入过量二氧化碳,碳酸钠能转化为碳酸氢钠,所以所用的除杂剂是,故答案为:CO2;
②除杂质:MgO(Al2O3),MgO不溶于强碱溶液,Al2O3能溶于强碱溶液生成可溶性的偏铝酸盐,然后采用过滤方法分离,所以除杂剂可以选取NaOH,故答案为:NaOH;
③除杂质:FeCl2溶液(FeCl3),氯化铁能和Fe反应生成氯化亚铁,然后采用过滤方法分离,所以除杂剂可以选取Fe,故答案为:Fe;
④鉴别:NaCl、KCl,二者阳离子不同,可以用焰色反应鉴别,钠元素焰色反应呈黄色、K元素焰色反应呈紫色,所以该操作名称是焰色反应,故答案为:焰色反应;
⑤鉴别:AlCl3、Al2(SO4)3溶液,二者区别是阴离子,氯化钡中钡离子能和硫酸根离子反应生成白色沉淀,而氯化铝和氯化钡溶液不反应,所以可以用BaCl2鉴别,故答案为:BaCl2.
①②③离子方程式分别为CO2+CO32-+H2O=2HCO3-、Al2O3+2OH-=2AlO2-+H2O、Fe+2Fe3+=3Fe2+,
故答案为:CO2+CO32-+H2O=2HCO3-;Al2O3+2OH-=2AlO2-+H2O;Fe+2Fe3+=3Fe2+.
点评 本题考查除杂,为高频考点,明确物质差异性是解本题关键,注意物质性质及分离提纯方法的选取,除杂时不能引进新的杂质且操作要简便.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
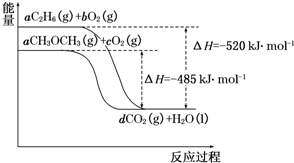 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液中和稀硝酸:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液的反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1(1-a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| C. | 向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动 | |
| D. | 向平衡后的体系中加入1molW,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com