
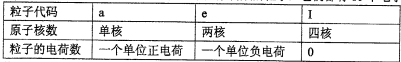
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
 |
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H +E(溶液)→M_____________________________,
F +G →A + B +C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是___________________。
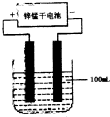
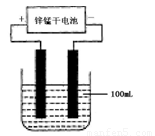
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)

解析:本题题干给出形式丰富,通过表格、流程图等表现方式综合考查了学生推理能力、化学基本用语、化工生产、电化学、pH的计算等方面的掌握程度。10电子微粒、18电子微粒是一直是高考考查的热点问题,通过表格不难判断:a为Na+,e为OH-,I为NH3。A由a、e 构成,则A为NaOH。根据流程图中I为NH3,推断K为O2(因为NH3的催化氧化是一个特征反应,且反应⑤是工业生产中的反应),则J和G为NO和H2O其中之一;因为C、D生成NH3(I),且反应③也是工业生产中的反应,则C、D为N2、H2之一;又因为反应④是工业反应,且有H2(C)和NaOH(A)生成,则联想到这个反应必定为氯碱工业:2NaCl + 2H2O  2NaOH + H2↑+Cl2↑,依次推出A为NaOH,B为Cl2,E为NaClO,F为NaCl,G是H2O,B为Cl2,C为H2,则H为HCl,M为HClO,K为O2,D为N2,L必为含氯化合物,N是NH3与NaClO溶液反应之后的产物之一。
2NaOH + H2↑+Cl2↑,依次推出A为NaOH,B为Cl2,E为NaClO,F为NaCl,G是H2O,B为Cl2,C为H2,则H为HCl,M为HClO,K为O2,D为N2,L必为含氯化合物,N是NH3与NaClO溶液反应之后的产物之一。
第(2)问中要求分别写出:HCl溶液与NaClO溶液反应的方程式、电解食盐水的离子方程式。H+ + ClO- = HClO;2 Cl- + 2H2O![]() Cl2+ H2 + 2OH-;
Cl2+ H2 + 2OH-;
第(3)问中根据原子守恒可知NaClO + 2NH3 == N + NaCl + H2O中,N为N2H4,该分子中各原子均达到惰性气体的稳定结构,则N原子要形成3根共价键,H原子要形成1根共价键。其结构式为:![]() 。
。
第(4)问也根据原子守恒来判断,L + 2NH3 == CO(NH2)2 + 2HCl,其中L为3种元素构成的分子,可判断L中必含有C、O和Cl,其分子式应为COCl2。其电子式为:![]() 。
。
第(5)问:反应③为合成氨反应,工业生产中它应在合成塔中进行;反应④为氯碱工业中反应,为防止H2和Cl2混合而爆炸,在电解池中应用阳离子交换膜,其作用是指允许溶液中的阳离子通过而不让分子或阴离子通过。
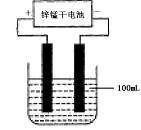
第(6)问:电解100mL NaCl溶液:2 Cl- + 2H2O![]() Cl2 + H2 + 2OH-,当产生0.005mol Cl2时,生成OH-的物质的量为0.01mol,浓度为0.1mol/L,pH为13。
Cl2 + H2 + 2OH-,当产生0.005mol Cl2时,生成OH-的物质的量为0.01mol,浓度为0.1mol/L,pH为13。
答案:(每空1分,共10分)
(1)Cl2 NO
(2)H+ + ClO- == HClO; 2 Cl- + 2H2O ![]() Cl2 +H2 + 2OH-
Cl2 +H2 + 2OH-
(3)![]()
(4)![]()
(5)合成塔;离子交换膜,只允许阳离子通过,阻止阴离子和气体通过
(6)13


科目:高中化学 来源: 题型:阅读理解


| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |

| ||
| ||


 的电子式
的电子式

查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市高三市二测模考(理综)化学部分 题型:填空题
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
e |
I |
|
原子核数 |
单核 |
两核 |
四核 |
|
粒子的电荷数[来源:学,科,网Z,X,X,K] |
一个单位正电荷 |
一个单位负电荷 |
0 |
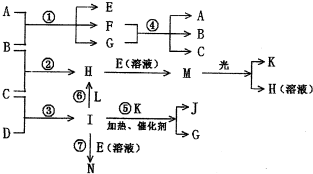
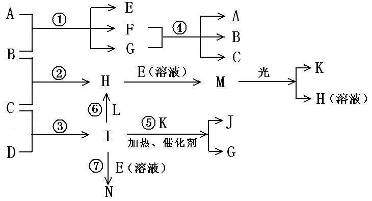
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
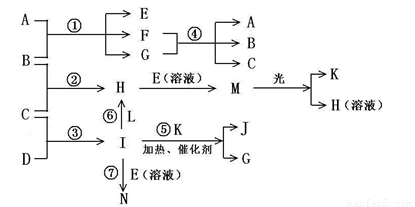
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
查看答案和解析>>
科目:高中化学 来源:2010届高三名校精粹重组 题型:填空题
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
e |
I |
|
原子核数 |
单核 |
两核 |
四核 |
|
粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
 |
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M_____________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是___________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com