
【题目】氢氧化钠是重要的化工原料,请回答下列问题:
(一)用氢氧化钠溶液制备NaClO、NaClO3等
(1)NaOH中所含化学键类型为______________。NaClO3的化学名称为_____________。
(2)已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+ NaClO(aq)+H2O(l) △H1= -102 kJ·mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+ NaClO3(aq)+3H2O(l) △H2= -422 kJ·mol-1
写出在溶液中NaClO分解生成 NaClO3的热化学方程式___________________________。
(二)用氢氧化钠溶液处理天然气中少量的羰基硫(COS)及利用的过程如下(部分产物已略去):![]() .
.
(3)羰基硫与CO2结构相似,则羰基硫分子的电子式为_______________。
(4)反应I除生成两种正盐外,还有水生成,其化学方程式为__________________。
(5)已知X溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为____________。
【答案】 离子键和(极性)共价键 氯酸钠 3NaC1O(aq)= 2NaCl(aq)+NaC1O3(aq) ΔH= -116kJ·mol-1 ![]() COS+4NaOH=Na2S+Na2CO3+2H2O 2S2-+5H2O
COS+4NaOH=Na2S+Na2CO3+2H2O 2S2-+5H2O ![]() S2O32-+4H2↑+2OH-
S2O32-+4H2↑+2OH-
【解析】(一)(1)NaOH属于离子化合物,存在离子键,同时存在氢氧共价键,NaClO3的化学名称为氯酸钠,故答案为:离子键和共价键;氯酸钠;
(2)Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJmol-1,Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJmol-1,盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
(二)(3)羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,故答案为:COS+4NaOH=Na2S+Na2CO3+2H2O;
(5)硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O=S2O32-+4H2↑+2OH-。


科目:高中化学 来源: 题型:
【题目】下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O![]() H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+![]() I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的选项是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期X、Y、Z、M、W为五种短周期元素.其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
A. 原素Z、W的简单离子的电子层结构不同
B. Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性
C. 由X元素形成的单质不一定是原子晶体
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使高锰酸钾酸性溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是( )
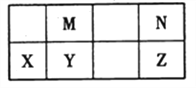
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下图所示装置进行实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:

(1)图中①、②、③、④装置可盛放的试剂是(填序号):①________;②________;
③________;④________。
A.品红溶液 B.氢氧化钠溶液
C.浓硫酸 D.高锰酸钾酸性溶液
(2)能说明二氧化硫气体存在的现象是_____________________。
(3)使用装置②的目的是_________________________________。
(4)使用装置③的目的是_________________________________。
(5)确定含有乙烯的现象是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com