
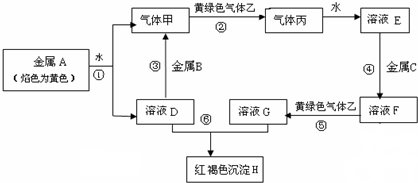
分析 金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,溶液D为氢氧化钠溶液,推断D为NaOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,气体丙为HCl,溶于水得到溶液E为盐酸溶液;溶液D和溶液G反应生成红褐色沉淀H判断H为Fe(OH)3,结合转化关系中的反应物性质,溶液G为FeCl3,溶液F为氯化亚铁溶液;推断出C为Fe,
(1)依据上述推断可知B为Al,丙为HCl;
(2)反应①是金属钠和水反应生成氢氧化钠和氢气的反应;
(3)分析可知H为氢氧化铁沉淀;
(4)溶液G为FeCl3,加入KSCN溶液反应生成血红色溶液.
解答 解:有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,溶液D为氢氧化钠溶液,推断D为NaOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,气体丙为HCl,溶于水得到溶液E为盐酸溶液;溶液D和溶液G反应生成红褐色沉淀H判断H为Fe(OH)3,结合转化关系中的反应物性质,溶液G为FeCl3,溶液F为氯化亚铁溶液;推断出C为Fe;
(1)依据上述推断可知B为Al,丙为HCl,故答案为:Al;HCl;
(2)反应①是金属钠和水反应生成氢氧化钠和氢气的反应,反应的化学反应方程式:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)反应⑥是氢氧化钠和氯化铁反应生成氢氧化铁沉淀的反应,反应的离子方程:Fe3++3OH-=Fe(OH)3↓,沉淀H为Fe(OH)3,故答案为:Fe(OH)3;
(4)往溶液G为FeCl3中滴入KSCN溶液出现红色溶液,Fe3++3SCN-=Fe(SCN)3,故答案为:出现红色溶液.
点评 本题考查了物质转化关系的推断和应用,物质特征性质的应用判断,主要考查钠铝铁及其化合物性质应用,化学方程式、离子方程式的书写方法,题目难度中等.


科目:高中化学 来源: 题型:实验题
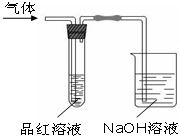 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
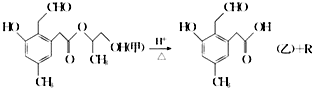
| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com