
����Ŀ��������ͼ��ʾת����ϵ�ж�����˵����ȷ���ǣ� ��
![]()
A.(C6H10O5)n�����ǵ��ۻ���ά�أ����߾����ڶ��ǣ���Ϊͬ���칹��
B.��������������Cu(OH)2����Һ��Ӧ����ש��ɫ����֤����Ӧ�ٵ����ղ���Ϊ������
C.���Ը��������Һ�ɽ��Ҵ�����Ϊ���ᣬ���պڵ�ͭ˿���Ȳ����Ҵ���Ҳ�ɵõ�����
D.��Ӧ�ڵõ��Ļ�����е��뱥������������Һ����Һ�ɵõ���������������
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y��ҽҩ�Ͼ��й㷺��;������X�Ƶá������йػ�����X��Y��˵����ȷ���ǣ� ��

A.X����������ԭ�ӿ�����ͬһƽ����
B.1molY�������1molNaOH��Ӧ
C.X��Y����������KMnO4��Һ��Ӧ
D.X��Y�ֱ�������H2�ӳɵIJ������������̼ԭ����Ŀ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ΰ�һ��������Ϻ��ۣ����Ƶû�����M����ѧʽΪxK2SO4��yCr2(SO4)3��������2.83g������M�е�Cr3+ȫ������ΪCr2O72-����Һ�е�Cr2O72-�ɺ���KI��Һ��Ӧ���õ�3.81gI2����Ӧ�����ӷ���ʽΪ��Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O����������2.83gM����Һ�У����������BaCl2��Һ������ϴ�Ӹ����ɵõ�4.66g��ɫ������
�ɴ��ƶϳ�������M��x��yΪ__��д����Ҫ������̣�__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() (x)��
(x)��![]() (y)��
(y)��![]() (z)��Ϊͬ���칹�壬����˵���� ��ȷ����
(z)��Ϊͬ���칹�壬����˵���� ��ȷ����
A.z �Ķ��ȴ���������
B.x��y��z ��ֻ�� x ������ԭ�ӿ��ܴ���ͬһƽ��
C.x��y ��ʹ������Ȼ�̼��Һ�����ӳɷ�Ӧ����ɫ
D.x��y ��һ�ȴ����ֻ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϣ���������Ϊԭ����ȡ���ش��������⡣
��1����ͳ�����ѽⷨ���ִ��������ѽⷨ���Ȼ�ѧ����ʽ���£�
��C2H6(g)=C2H4(g)+H2(g) ��H1=+136kJ��mol-1
��C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ��H2=-110kJ��mol-1
O2(g)=C2H4(g)+H2O(g) ��H2=-110kJ��mol-1
��֪��Ӧ��صIJ��ֻ�ѧ�������������£�
��ѧ�� | H-H(g) | H-O(g) | O=O |
����(kJ��mol-1) | 436 | x | 496 |
�ɴ˼���x=___��ͨ���Ƚ���H1����H2��˵�������ѽⷨ��ȣ������ѽⷨ���ŵ���___(��дһ��)��
��2������������ѽⷴӦ�����г���C2H4�⣬������CH4��CO��CO2�ȸ�����(����Ӧ��Ϊ���ȷ�Ӧ)��ͼ��Ϊ�¶ȶ����������ѽⷴӦ���ܵ�Ӱ�졣�����ת�������¶ȵ����߶����ߵ�ԭ����___����Ӧ������¶�Ϊ___(�����)��
A.700�� B.750�� C.850�� D.900��
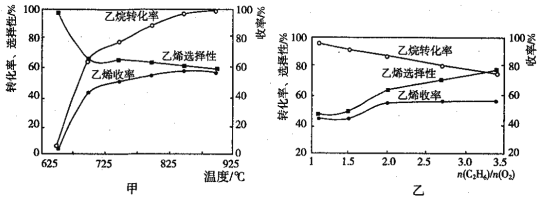
[��ϩѡ����=![]() ����ϩ����=����ת��������ϩѡ����]
����ϩ����=����ת��������ϩѡ����]
��3������������Ӧ�У����������ͻᵼ�·�Ӧ������̿������Ӧ�ܡ�ͼ��Ϊ![]() ��ֵ�����������ѽⷴӦ���ܵ�Ӱ�졣�ж����������ѽ������
��ֵ�����������ѽⷴӦ���ܵ�Ӱ�졣�ж����������ѽ������![]() �����ֵ��___���жϵ�������___��
�����ֵ��___���жϵ�������___��
��4����ҵ�ϣ�������ϵ��ѹ�㶨Ϊ100kPa�������½��и÷�Ӧ��ͨ��������������Ļ�������в����������(����������������Ϊ70%)��������������Ŀ����___����Ӧ��ƽ��ʱ������ֵ�����������±���
��� | C2H6 | O2 | C2H4 | H2O | �������� |
�������/% | 2.4 | 1.0 | 12 | 15 | 69.6 |
������¶��µ�ƽ�ⳣ����Kp=___(��ƽ���ѹ����ƽ��Ũ�ȣ�ƽ���ѹ=��ѹ���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������е� 4����ԭ�Ӷ�������ȡ�����ɵõ����ӽṹΪ���� ����Ը��л����������������ȷ���ǣ�����
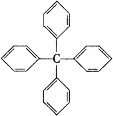
A.����ʽΪ C25H24
B.���ڱ���ͬϵ��
C.����̼ԭ���п��ܴ���ͬһƽ����
D.��һ�������£��ܷ���ȡ�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����4��̼ԭ�ӽ�ϳɵ� 5 ���л���(��ԭ��û�л���)������˵����ȷ����
a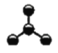 b
b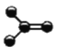 c
c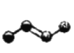 d
d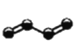 e
e![]()
A.�л���(a)��ϰ��������������Ϊ�����
B.�л���(a)���ĸ�̼ԭ�Ӿ�����
C.�����л�������(c)��Ϊͬ���칹���ֻ��(b)
D.�����л����в�������ˮ��Ӧʹ����ɫ����(a)��(e)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2-����������Ҫ�������Ϳ����������Ӽ������������л��ϳɺ���Ѭ�����õ��ܼ���ʵ�������Ҵ���Ũ�����Ʊ���ϩ���ϳ�1��2-�������飬��Ӧԭ��Ϊ��CH2 = CH2 + Br2��CH2BrCH2Br����Ӧװ����ͼ(����װ��ʡ��)��
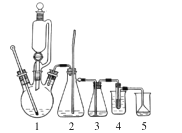
ʵ�鲽�裺
����ͼ��װ���������ڱ�ˮ��ȴ�£��� 24 mL Ũ���Ỻ�����뵽 12 mL �Ҵ��У���Ͼ��Ⱥ�ȡ 6 mL ���뵽������ƿ�У�ʣ�ಿ�ֵ����ѹ��Һ©���С�
��ȡһ֧ 20 mL �����˹ܣ���ȡ 3.0 mL(0.1 mol)Һ�嵹�����˹��У��ټ��� 3~5 mL ˮ�������˹ܷ��� 4 ���ձ��С�
�ۼ���װ�� 1 ǰ�����ж�װ�� 3 �� 4 �����Ӵ������¶�������Լ 120 ��ʱ���ֿ����ѱ��ų���Ȼ������ 3 �� 4�����¶�������Լ 170 ��ʱ����ϩ��������ʼ�����μ��Ҵ�-������Һ����ά���¶��� 170~200 �����ң��������ɫȫ����ȥ����Ӧ���������
�ܷ�Ӧ��ɺ���ȡ�����˹ܣ���ֹͣ���ȡ�������ת������Һ©���У������Ե������ˮ��1%��������ˮ��Һ��ϴһ�Σ�����ˮϴ���������ԡ�����������ˮ�Ȼ��Ƹ���ֲ�Ʒ�����ˡ������ռ� 129~132�����֣����� 5.7g���ش��������⣺
(1)��ϩ����ķ�Ӧ����Ϊ _______��Ӧ����װ������������� _____________��
(2)װ�� 1 Ϊ��ϩ����������Ӧ��Ũ����������� ____________________��
(3)װ�� 2 Ϊ��ȫƿ����ϵͳ����������2 �е�����Ϊ ____________________��
(4)�Ʊ���ϩʱ���������Ҵ��������ĸ���Ӧ�����ɶ�����̼��������������塢��װ�� 3 ϴ��ƿ�е��Լ�Ϊ________����ȥ��װ��3����װ�� 4 �п��ܷ����ĸ���Ӧ�Ļ�ѧ����ʽΪ ___________________��
(5)�� 1 �е��ٹ��죬���ܲ�����Ӱ��Ϊ��ϩ���������巴Ӧ���ܵ���ͬʱҲ�����һ���������װ�� 5(5% ����������Һ)�����Ͳ��ʡ�װ��4���˹��м�ˮ��Ŀ����________����֪������������NaOH ��Ӧ����������ֻ��NaBrO3��д���÷�Ӧ�����ӷ���ʽ _____________��
(6)���㱾ʵ��IJ��ʣ�______________ (����һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2SiO3����һ��������ˮ�����ᣬ����Һ������ʱ���γ�����״������ʵ���ҳ��� Na2SiO3 ��Һ�Ʊ����ᡣijС��ͬѧ����������ʵ�飺
��� | �� | �� |
ʵ�� |
|
|
���� | a �в�������״���� | b ������״�����ܽ⣬c �������Ա仯 |
���н��۲���ȷ����
A.Na2SiO3 ��Һһ���Լ���
B.�� �� �� �� ˵ �� �� �� H2CO3��H2SiO3
C.�ɢ��֪��ͬŨ��ʱ Na2CO3 ��Һ�ļ���ǿ�� NaHCO3 ��Һ
D.�� Na2SiO3 ��Һ��ͨ����� CO2��������Ӧ��SiO32��+CO2+H2O=CO32��+H2SiO3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com