
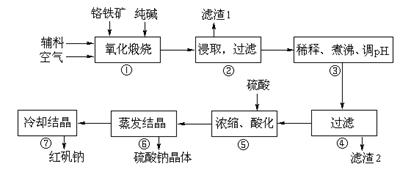
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
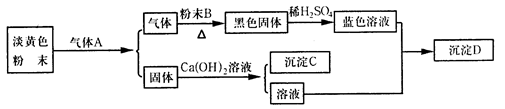
科目:高中化学 来源:不详 题型:实验题
| 你对紫罗兰花瓣遇盐酸变红现象的各种假设 | 你验证假设的实验方案 |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。
(1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②①④③ | B.①②③④ | C.③①②④ | D.④③②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com