
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
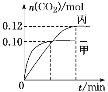
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
【答案】AB
【解析】
A、甲、丙容器中起始投料相同,温度不同,由图中曲线分析甲的温度高,即T1>T2,平衡时n(CO2)甲<n(CO2)丙,说明升高温度,平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应,升高温度,平衡常数减小,平衡常数K(T1)<K(T2),选项A正确;
B、丙容器中反应达到平衡时,
2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始/(mol/L ): 0.1 0.1 0 0
变化/(mol/L): 0.06 0.06 0.03 0.06
平衡/( mol/L): 0.04 0.04 0.03 0.06
此时,NO的转化率为60%;乙容器中若加入0.05 mol/LN2、0.1 mol/L CO2与丙等效,达到平衡时, N2的转化率等于40%,乙容器中加入0.1 mol/L N2、0.2 mol/L CO2,相当于丙物质的量的两倍,加压平衡向正反应方向移动,使N2的转化率小于40%,选项B正确;
C、根据表中数据和图像可知,甲平衡时气体总物质的量为0.35nol,丙平衡时气体总物质的量为0.34mol,根据B的分析,乙相当于在丙的基础上增大压强,平衡正向移动,乙平衡时气体物质的量小于0.68mol<2×0.35mol,乙的温度低于甲,乙平衡时气体压强小于甲的2倍, 选项C错误;
D、丙容器中反应达到平衡时,平衡常数K=![]() = 42.1875,再充入0.10 mol NO和0.10 mol CO2,浓度商Qc=
= 42.1875,再充入0.10 mol NO和0.10 mol CO2,浓度商Qc=![]() =28.01<K,反应向正反应方向进行,υ(正)>υ(逆),选项D错误。
=28.01<K,反应向正反应方向进行,υ(正)>υ(逆),选项D错误。
答案选AB。


科目:高中化学 来源: 题型:
【题目】下列各物质中所含原子个数由大到小的顺序正确的是( )
①0.3molNH3 ②标准状况下22.4L氯气 ③9mL H2O (4℃) ④0.2mol H3PO4
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
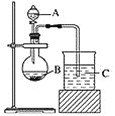
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应:xA(g)+yB(g) ![]() zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
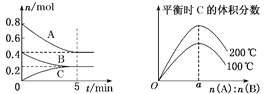
图1 图2
A.反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率υ(B)=0.04 mol·L-1·min-1
C.若在图1所示的平衡状态下,再向体系中充入He,此时υ(正)>υ(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组分别设计了一组实验来探究元素周期律。
第一小组根据元素非金属性与其对应最高价含氧酸之间的关系,设计了如图装置来一次性完成同主族元素非金属性强弱比较的实验探究。
[查阅资料]
Ⅰ.常温下浓盐酸与高锰酸钾能反应生成氯气。
Ⅱ.H2SiO3难溶于水。
实验药品:大理石、碳酸钠粉末、稀硝酸、硅酸钠溶液。
[探究过程]
(1)第一小组为比较N、C、Si的非金属性强弱,以图中装置进行实验:
①烧杯C中现象为__________,发生反应的离子方程式为________________。
②实验预期结论:_______________________________________。
③存在问题:___________________________________________。
(2)第二小组设计了下图装置来验证卤素单质的氧化性,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
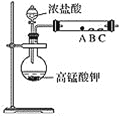
①写出A处反应的离子方程式:_______________________________。
②B处实验现象是____________________________________________。
③实验预期结论:____________________________________________。
④存在问题:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
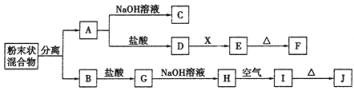
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
①用A表示的反应速率是0.4mol·L-1·min-1
②在2min末时,反应物B的反应速率是0.3mol·L-1·min-1
③在这2min内用C表示的平均速率为0.2mol·L-1·min-1
④在2min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1mol·L-1,则2 min时D的浓度为0.3mol·L-1
A.①②③B.②③⑤C.④⑤D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com