
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的浓盐酸物质的量浓度约为10.0molL-1。
(1)实验室欲用上述浓盐酸配制500mL0.20molL-1的稀盐酸溶液,则需要取上述浓盐酸_________mL
(2)配制过程中,不需要的仪器(填写代号)_________。
A.药匙 B.胶头滴管 C.500mL容量瓶 D.烧杯
完成该实验还缺少的两个玻璃仪器是______________、______________(填仪器名称)
(3)下列操作会导致所配制的溶液浓度偏高的是__________。
A.转移溶液前容量瓶内含有少量的蒸馏水
B.定容时俯视容量瓶刻度线
C.定容摇匀后,发现容量瓶液面低于刻度线,再滴加水至刻度线
D.未洗涤烧杯内壁和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
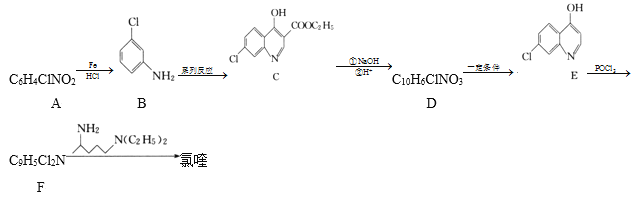
【题目】氯喹(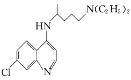 )可用于治疗新冠肺炎,氯喹的合成方法如图:
)可用于治疗新冠肺炎,氯喹的合成方法如图:
已知: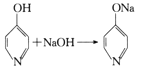 +H2O。
+H2O。
回答下列问题:
(1)A中所含官能团的名称是__,C的分子式为___。
(2)A生成B的反应类型为___,E生成F的反应类型为__。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。氯喹中的手性碳有__个。
(4)由C生成D的过程中,加入NaOH溶液时发生反应的化学方程式为___。
(5)X为E的同分异构体,写出一种满足如下条件的X的结构简式:___。
①遇FeCl3溶液发生显色反应
②除苯环外不含其他环,且苯环上只有2个取代基
③含有—CN
④核磁共振氢谱中只有4组峰,且峰面积之比为1:2:2:1
(6)设计以 、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成
、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成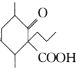 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
已知:R1CH2COOR2![]() R1CH(R3)COOR2
R1CH(R3)COOR2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g) ![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
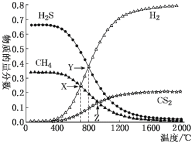
下列说法正确的是
A.该反应的ΔH<0
B.X点与Y点容器内压强比为55∶51
C.X点CH4的转化率为20%
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1 mol 时υ(正)<υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
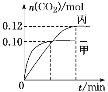
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3B.6∶3∶2C.3∶1∶1D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
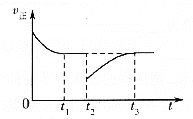
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
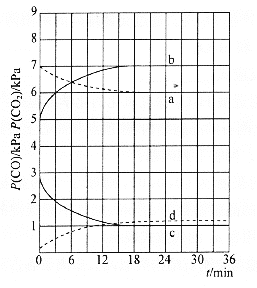
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com