
【题目】研究![]() 之间的转化具有重要意义。
之间的转化具有重要意义。
(1)已知:![]()
![]()
将一定量![]() 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为![]() 。
。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.![]() C.K不变
C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②![]() 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p,![]() 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应![]() 的平衡常数
的平衡常数![]() ________(对于气相反应,用某组分B的平衡压强
________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() ,如
,如![]() ,p为平衡总压强,
,p为平衡总压强,![]() 为平衡系统中B的物质的量分数)。
为平衡系统中B的物质的量分数)。
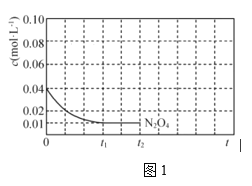
③反应温度![]() 时,
时,![]() 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出![]() 时段,
时段,![]() 随t变化曲线____________。
随t变化曲线____________。
保持其它条件不变,改变反应温度为![]() ,再次画出
,再次画出![]() 时段,
时段,![]() 随t变化趋势的曲线。
随t变化趋势的曲线。
(2)![]() 氧化反应:
氧化反应:![]() 分两步进行,其反应过程能量变化示意图如图2。
分两步进行,其反应过程能量变化示意图如图2。
I ![]()
![]()
II ![]()
![]()
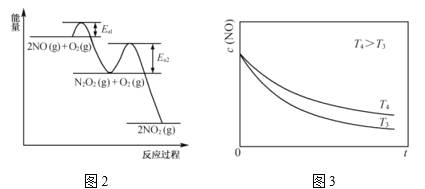
①决定![]() 氧化反应速率的步骤是________(填“I”或“II”)。
氧化反应速率的步骤是________(填“I”或“II”)。
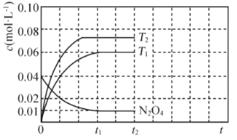
②在恒容的密闭容器中充入一定量的![]() 和
和![]() 气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得
气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得![]() 随t(时间)的变化曲线如图3。
随t(时间)的变化曲线如图3。
转化相同量的![]() ,在温度_________(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因________。
,在温度_________(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因________。
【答案】AE ![]()
 II
II ![]()
![]() ,温度升高,反应I平衡逆移,
,温度升高,反应I平衡逆移,![]() 减小;浓度降低的影响大于温度对反应II速率的影响
减小;浓度降低的影响大于温度对反应II速率的影响
【解析】
(1)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
②根据转化率求出平衡时各物质的物质的量分数,K![]() ,
,![]() ,p为平衡总压强,据此计算;
,p为平衡总压强,据此计算;
③根据平衡时N2O4的浓度求出平衡式NO2的浓度,t1~ t2平衡不移动,浓度不变;该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,据此分析;
(2)①正反应活化能较大的步骤决定整体反应速率;
②转化量相同,即c(NO2)相同;根据反应过程能量图可知![]() ,温度升高反应I平衡左移。
,温度升高反应I平衡左移。
(1)①A.恒容条件下平衡正向移动时压强增大,所以当压强不再变化时说明反应达到平衡,故A正确;
B.平衡时v正(N2O4) =v逆(N2O4) ;2v逆(N2O4) = v逆(NO2),故B错误;
C.温度不变K不变,故C错误;
D.容器内气体的质量不变,且恒容所以密度不会改变,故D错误;
E. NO2显红棕色,平衡正向移动颜色加深,故颜色不变时说明反应平衡,故E正确;
②恒容条件下压强比等于气体的物质的量之比,设初始时刻N2O4的物质的量为n,![]() 气体的平衡转化率为75%,则平衡时N2O4的物质的量为0.25n,生成的NO2的物质的量为1.5n,所以p(N2O4)=
气体的平衡转化率为75%,则平衡时N2O4的物质的量为0.25n,生成的NO2的物质的量为1.5n,所以p(N2O4)=![]() ,p(NO2)=
,p(NO2)=![]() ,K
,K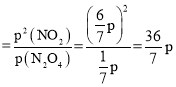 ;
;
③初始时刻充入一定量![]() ,c(N2O4)=0.04mol/L,则t0时刻c(NO2)=0,t1时刻反应达到平衡,平衡时c(N2O4)=0.01 mol/L,根据方程式可知c(NO2)= 0.06mol/L,t1~ t2平衡不移动,浓度不变;保持其它条件不变,升高温度至T2,该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,故再次平衡时c(NO2)>0.06mol/L,温度升高反应速率加快,达到平衡所需时间缩短,平衡时刻在t1时刻之前,故图象为:
,c(N2O4)=0.04mol/L,则t0时刻c(NO2)=0,t1时刻反应达到平衡,平衡时c(N2O4)=0.01 mol/L,根据方程式可知c(NO2)= 0.06mol/L,t1~ t2平衡不移动,浓度不变;保持其它条件不变,升高温度至T2,该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,故再次平衡时c(NO2)>0.06mol/L,温度升高反应速率加快,达到平衡所需时间缩短,平衡时刻在t1时刻之前,故图象为:
 ;
;
(2)①根据反应过程能量图可知步骤II反应活化能较大,起决定因素;
②据图可知当c(NO2)相同时,T4温度下消耗的时间较长;![]() ,温度升高,反应I平衡逆移,
,温度升高,反应I平衡逆移,![]()


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
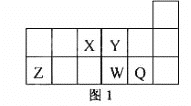
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的化工原料,可发生如下转化。下列说法中不正确的是( )
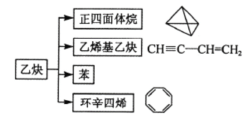
A.以上转化均为加成反应
B.正四面体烷的二氯代物只有1种结构
C.苯乙烯(![]() )和环辛四烯互为同分异构体
)和环辛四烯互为同分异构体
D.等质量的苯和乙烯基乙炔充分燃烧时消耗氧气的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置图的叙述中,正确的是

① ②
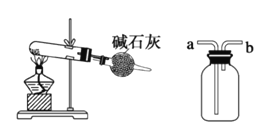
③ ④
A. 装置①:常用于分离互不相溶的液体混合物
B. 装置②:可用于吸收氯化氢、氨气等气体尾气,防止倒吸
C. 装置③:可用于实验室以氯化铵为原料制备少量NH3的实验
D. 装置④:先装满水,再从b口进NO气体,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
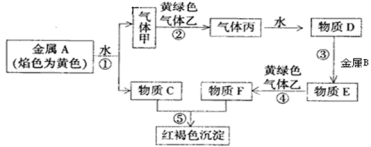
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.铝粉投入到NaOH溶液中:Al+2OH-=![]() +H2↑
+H2↑
C.氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+
D.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2SO4+2NaOH==Na2SO4+2H2O
B. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
C. NH3+HCl==NH4Cl
D. CuO+H2![]() Cu+H2O
Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com