
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
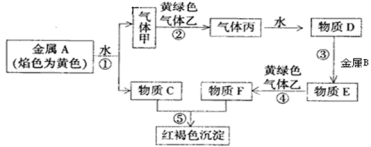
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
【答案】HCl ![]() Cl2+2OH-=Cl-+ClO-+H2O 白色沉淀迅速变为灰绿色,最后变为红褐色 抑制Fe3+水解,Fe3++3H2O
Cl2+2OH-=Cl-+ClO-+H2O 白色沉淀迅速变为灰绿色,最后变为红褐色 抑制Fe3+水解,Fe3++3H2O![]() Fe(OH)3+3H+ 取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+
Fe(OH)3+3H+ 取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+
【解析】
金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀为Fe(OH)3,由反应①Na→气体甲+C,为Na与水的反应,生成甲为H2,C为NaOH,H2和Cl2反应生成气体丙,丙为HCl,D为盐酸溶液,由HCl+金属B→E可知,B为金属Fe,E为FeCl2,FeCl2与Cl2反应生成F,则F为FeCl3。据此解答。
(1)由上面的分析可知,丙的化学式为HCl;故答案为HCl;
(2)A的一种氧化物为淡黄色固体,为过氧化钠,该物质的电子式为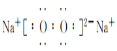
答案为: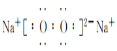
(3)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl- +ClO-+H2O;答案为:Cl2+2OH-=Cl- +ClO-+H2O;
(4)若将NaOH溶液与FeCl2溶液混合发生反应生成氢氧化亚铁白色沉淀,氢氧化亚铁在空气中不稳定,白色沉淀迅速变为灰绿色,最后变为红褐色;答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;
(5)FeCl3为强酸弱碱盐,Fe3+发生水解生成Fe(OH)3:Fe3++3H2O![]() Fe(OH)3+3H+,先加入较浓的盐酸可抑制Fe3+水解;答案为:抑制Fe3+水解,Fe3++3H2O
Fe(OH)3+3H+,先加入较浓的盐酸可抑制Fe3+水解;答案为:抑制Fe3+水解,Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(6)检验物质FeCl2溶液中Fe2+方法为:取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+;答案为:取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
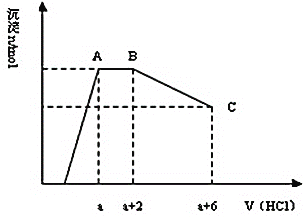
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 1 L![]() 的溶液中
的溶液中![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]()
![]() 为 4 的NaHA溶液中:
为 4 的NaHA溶液中:![]()
D. 等浓度的碳酸钠和碳酸氢钠混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
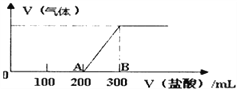
则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com