
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 1 L![]() 的溶液中
的溶液中![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]()
![]() 为 4 的NaHA溶液中:
为 4 的NaHA溶液中:![]()
D. 等浓度的碳酸钠和碳酸氢钠混合溶液中:![]()
【答案】D
【解析】
A.1 L![]() 的溶液中存在电荷守恒,即c(NH4+)+2c(Fe2+)+c(H+)=c(OH-)+2c(SO4 2-),故A错误;
的溶液中存在电荷守恒,即c(NH4+)+2c(Fe2+)+c(H+)=c(OH-)+2c(SO4 2-),故A错误;
B.根据物料守恒,![]() 溶液中存在c(NH4+)+c(NH3·H2O)=c(HS-)+c(H2S)+c(S2-),所以c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B错误;
溶液中存在c(NH4+)+c(NH3·H2O)=c(HS-)+c(H2S)+c(S2-),所以c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B错误;
C.0.1molL-1 NaHA溶液pH为4,溶液显酸性,说明HA-电离程度大于水解程度,所以c(A2-)>c(H2A),故C错误;
D.等浓度的碳酸钠和碳酸氢钠混合液中,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),所以得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确;
答案选D。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p%B. 大于p%C. 小于p%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)
1918年,德国化学家哈伯因发明工业合成氨的方法而荣获诺贝尔化学奖。
(1)若将1 mol N2和3 mol H2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为________mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是________________。
a. υ(N2)正=3υ(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)若1 mol N2完全转化为NH3的反应热为![]() H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)
1998年,两位希腊化学家提出了电解合成氨的新思路:
采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
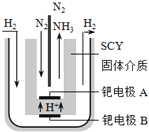
钯电极A是电解池的________极(填“阳”或“阴”),阳极反应式为__________________。
(方法三)
最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H=-92 kJ/mol
H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) ![]() H=-571.6 kJ/mol
H=-571.6 kJ/mol
写出上述固氮反应的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述正确的是( )
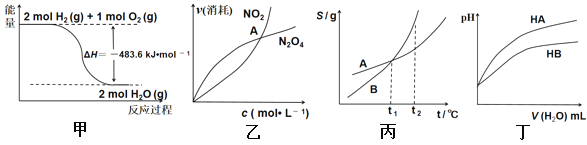
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B. 乙表示恒温恒容条件下发生的可逆反应2NO2 (g)![]() N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所涉及的物质均为中学化学中的常见物质,其中C、D均为气体单质,E是固体单质,A物质的焰色反应火焰为紫色,F是黑色晶体,它们存在如图转化关系,反应中生成的水及次要产物均的已略去。

(1)写出下列物质的化学式:C_____________,D______________,H____________。
(2)指出MnO2在相关反应中的作用:反应①中做_______剂,反应②中做_________剂。
(3)当①中有1molA完全反应时转移电子的物质的量是________mol。
(4)检验G中阳离子的方法_________________________________________ 。
(5)保存G溶液时为什么要加固体E_____________________________________。
(6)写出F→G+H的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
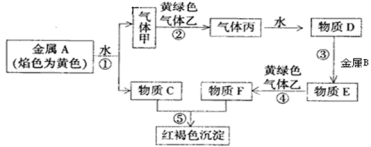
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A. FeCl3溶液滴入Mg(OH)2浊液,白色浊液转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄色褪去
C. Na放在坩埚里并加热,发生黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:

下列说法正确的是( )
A. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述制备过程所涉及的物质中只有一种酸性氧化物
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A. AlN中氮的化合价为+3B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 gD. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com