
【题目】关于下列各图的叙述正确的是( )
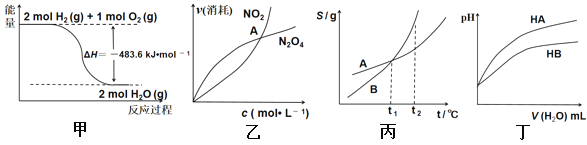
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B. 乙表示恒温恒容条件下发生的可逆反应2NO2 (g)![]() N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
【答案】D
【解析】
A、燃烧热是1mol可燃物燃烧生成稳定的氧化物释放的热量,液态水是稳定的,且上图是2mol氢气燃烧放出的热量,故A错误;
B、反应2NO2N2O4(g)中,由图象可知,在A点反应物的消耗速率和生成物的消耗速率相等,其表明正反应速率和逆反应速率不等,没有达到化学平衡状态,故B错误;
C、t1℃时AB浓度相同,升温时,均无溶质析出,溶液的浓度不变,溶质的质量分数B等于A,故C错误;
D、随加水量的增多,HA的pH变化大,说明HA的酸性强于HB,根据越弱越水解的原则,NaB水解程度大,故NaA溶液的碱性弱于同浓度的NaB溶液的碱性,NaA溶液的pH小于同浓度的NaB溶液的pH,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H=___。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
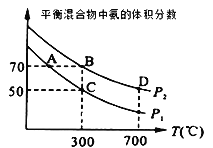
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. ![]() 保持不变 D.
保持不变 D. ![]() =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
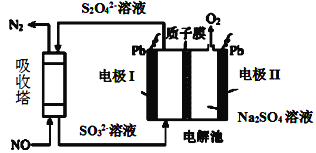
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 整个过程涉及一个复分解反应和两个氧化还原反应
D. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
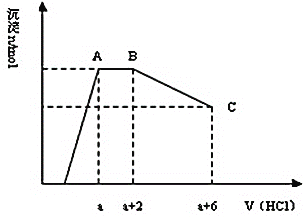
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氟化氢气体中有平衡系:
①2H3F3(g)=3H2F2(g ) ΔH1=akJ·mol-1 ②H2F2 (g)=2HF(g) ΔH2=bkJ·mol-1 已知a、b均大于0,则可推测反应:H3F3(g)=3HF(g)的ΔH3等于( )
A. (a+b) kJ·mol-1B. (a-b) kJ·mol-1
C. (a+3b) kJ·mol-1D. (0.5a+1.5b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 1 L![]() 的溶液中
的溶液中![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]()
![]() 为 4 的NaHA溶液中:
为 4 的NaHA溶液中:![]()
D. 等浓度的碳酸钠和碳酸氢钠混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
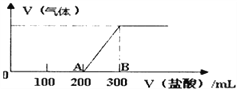
则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com