
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:

下列说法正确的是( )
A. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述制备过程所涉及的物质中只有一种酸性氧化物
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
【答案】A
【解析】
先向碳酸钠饱和溶液中通入SO2,得到NaHSO3溶液,然后加入碳酸钠固体,使溶液的pH升高,NaHSO3转化为Na2SO3,再次通入SO2,使Na2SO3和SO2以及水反应生成NaHSO3,得到NaHSO3的过饱和溶液,最后结晶脱水得到Na2S2O5。
A. SO2和碳酸钠固体很难反应,不能得到pH=4.1的溶液,所以Na2CO3饱和溶液和Na2CO3固体不可互换,故A选;
B. Na2S2O5作防腐剂,表现还原性,SO2作漂白剂时,表现的是SO2的漂白性,故B不选;
C. SO2通入Na2CO3饱和溶液中生成了CO2,所以涉及的物质中不是只有一种酸性氧化物,故C不选;
D.结晶脱水是加热固体分解,在坩埚中进行,且需要用到酒精灯,故D不选。
故选A。


科目:高中化学 来源: 题型:
【题目】工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 整个过程涉及一个复分解反应和两个氧化还原反应
D. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 1 L![]() 的溶液中
的溶液中![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]()
![]() 为 4 的NaHA溶液中:
为 4 的NaHA溶液中:![]()
D. 等浓度的碳酸钠和碳酸氢钠混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
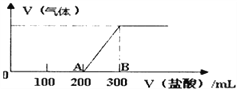
则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的化学方程式正确的是
A. FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B. 90℃时,测得纯水中c(H+)·c(OH-)=3.8 ×10-13:H2O(l)![]() H+(aq)+OH-(aq)△H<0
H+(aq)+OH-(aq)△H<0
C. 氨水中滴入酚酞溶液.溶液变红:NH3·H2O=NH4++OH-
D. 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某反应体系中存在六种粒子:ClO4-、SO42-、ClO3-、S2O82-、H+、H2O。在反应过程中,溶液的 pH 与反应进程的关系如图所示。下列说法正确的是

A. ClO4-是氧化剂
B. SO42-是氧化产物
C. 氧化性:S2O82->ClO3-
D. 生成 1 mol 还原产物时转移 2 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是 ( )
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B. 中和pH、体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C. pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com