
| a | ||||
| b | ||||
| c | d | |||
| e |
| A. | b元素除0价外,只有一种化合价 | |
| B. | c元素只能形成一种氢化物且很不稳定 | |
| C. | d元素是五种元素中原子半径最小的一种 | |
| D. | e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
分析 a、b、c、d、e为周期表前4周期的一部分元素,由位置可知,a为He,b为O,d为Cl,c为Si,e为As,
A.O元素的化合价为0、-1、-2价;
B.C与Si相似,可形成多种氢化物;
C.电子层越少,原子半径越小;
D.e元素最高价氧化物的水化物与磷酸相似,为三元酸.
解答 解:a、b、c、d、e为周期表前4周期的一部分元素,由位置可知,a为He,b为O,d为Cl,c为Si,e为As,
A.O元素的化合价为0、-1、-2价,如氧气、过氧化氢、水,故A错误;
B.C与Si相似,可形成多种氢化物,则则不止一种氢化物,但很不稳定,故B错误;
C.电子层越少,原子半径越小,则a元素是五种元素中原子半径最小的一种,故C错误;
D.e元素最高价氧化物的水化物与磷酸相似,为三元酸,和不同量的氢氧化钠溶液反应,可能生成三种盐,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素在周期表的位置,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
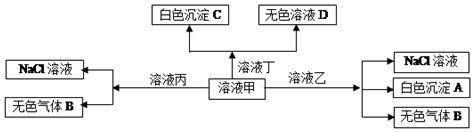
| A. | 在甲中滴加丁开始反应的离子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12和pH=8的氢氧化钠溶液等体积混合后溶液的pH值为10 | |
| B. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1 mol•L-1醋酸中c(H+)之比为2:1 | |
| D. | NO2溶于水时,氧化产物与还原产物的质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com