
【题目】近日,中国科学院深圳先进技术研究院研发出一种高性能的钙离子电池:以溶有六氟磷酸钙Ca(PF6)2的碳酸酯类溶剂为电解液,放电时合金Ca7Sn6发生去合金化反应,阴离子(PF6)从石墨烯中脱嵌,进入电解质溶液。放电时其工作原理如下图,下列说法错误的是(已知:比能量为单位质量的电极放出电能的大小)
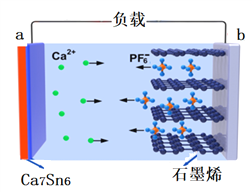
A. 电池放电时,化学能转化为电能和热能
B. 放电时,a电极的电极反应方程式为:Ca7Sn6 —14e- =7Ca2+ + 6Sn
C. 充电时,b电极接电源的正极
D. 与锂离子电池相比较钙离子电池具有材料储量丰富、比能量高的优点
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。
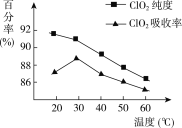
请回答下列问题:
(1)据图可知,反应时需要控制的适宜温度是________ ℃,达到此要求采取的适宜措施是________。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:____________________________________。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0 g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.0500 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++6Fe2++Cr2O72-===2Cr3++6Fe3++7H2O
试计算ClO2的“产率”为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能使pH试纸显蓝色的溶液中:Na+、ClO-、Fe3+、SO42-
B. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
C. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
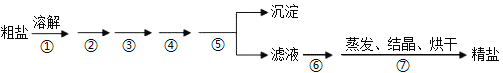
A. 在第①步中使用玻璃棒搅拌可加速粗盐溶解
B. 第⑤步操作是过滤
C. 在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D. 除去MgCl2的离子方程式为:Mg2++2OH=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
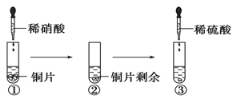
①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不正确的是( )
A.用托盘天平称取 4.5 g 固体氯化钠B.在烧杯中稀释浓硫酸
C.用温度计代替玻璃棒搅拌溶液D.在蒸发皿中蒸发浓缩食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1molHNO3和1molH2OS4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是()
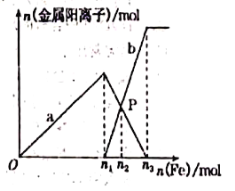
A. a表示n(Fe3+)的变化曲线
B. n1=0.75
C. P点时,n(Fe2+)=0.5625 mol
D. 向P点溶液中加入铜粉,最多可溶解14.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com