
用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值 110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量 57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:

P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
(16分)(1)=;(2)>;(3)<;(4)>;(5)>;(6)①< ②< ③>
【解析】
试题分析:(1)根据盖斯定律可知,反应热只与反应物和生成物的始态与终态有关系,而与反应条件无关系,所以ΔH1=ΔH2;
(2)断键是吸热的,而形成化学键是放热的,因此相同条件下,2mol氢原子所具有的能量>1mol氢分子所具有的能量;
(3)常温时红磷比白磷稳定,这说明白磷的总能量高于红磷的总能量,所以白磷转化为红磷是放热反应。根据盖斯定律可知,①-②即得到反应4P(白磷,s)=4P(红磷,s),则该反应的反应热△H=ΔH1-ΔH2<0,所以ΔH1<ΔH2;
(4)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。由于碳完全燃烧放出的热量高于碳不完全燃烧放出的热量,所以根据热化学方程式2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1可知,碳的燃烧热数值>110.5 kJ·mol-1;
(5)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水放出热量,所以根据方程式H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol可知,浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量>57.3 kJ;
(6)①根据图像可知,压强为P2的曲线首先达到平衡状态,由于压强大反应速率快,达到平衡的时间少,所以压强是P2大于P1,即P1<P2;
②根据图像可知,压强越大,反应物A的转化率越低,这说明增大压强平衡向逆反应方向越低,因此正方应是体积增大的可逆反应,所以(a+b)<(c+d);
③根据图像可知,t1℃是曲线首先达到平衡状态,由于温度高,反应速率快,达到平衡的时间少,所以温度应该是t1℃> t2℃。
考点:考查反应热的判断、计算;外界条件对反应速率和平衡状态的影响以及图像识别等


科目:高中化学 来源: 题型:
 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.



查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
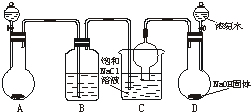 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com