
����Ŀ��25��ʱ����0.1000mol/L��AgNO3��Һ�ֱ�ζ������ΪV0mL����Ũ�Ⱦ�Ϊ0.1000molL��KCl��KBr��KI��Һ����ζ���������ͼ������֪25��ʱ��AgCl��AgBr��AgI�ܶȻ���������Ϊl.8��10-10��5.0��10-13��8.3��10-17��������˵����ȷ����

A. V0= 45.00
B. �ζ���������ʾKCl�ĵζ�����
C. �ζ�KClʱ���ɼ���������KI��ָʾ��
D. ��AgNO3��Һ�ζ���60.00mL ʱ����Һ�� c(I-)-)-)
���𰸡�D
�������������������25��ʱAgCl��AgBr��AgI�ܶȻ���������Ϊl.8��10-10��5.0��10-13��8.3��10-17��ͼ���֪�� ��V0= 50.00ʱ�ﵽ�ζ��յ㣬c(Ag+)�ɴ�С������AgCl��AgBr��AgI������pAg��С��������ΪAgCl��AgBr��AgI�������ۢ�������ΪKCl��KBr��KI��Һ�ĵζ����ߣ��ڵζ��ζ�KClʱ��������KI��ָʾ������ΪAgI�ܶȻ�������С��AgI�����׳�����ͬ������AgNO3��Һ�ζ���60.00mL ʱ��AgNO3��Һ����10.00mL����Һ�е�c(Ag+)��ͬ��������Һ�� c(I-)<c(Br-)<c(Cl-)������������D��ȷ������ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.�Ҵ����Ҷ�����Ϊͬϵ��B.H��D��T��Ϊͬλ��
C.����ϩ������̼�ܻ�Ϊͬ��������D.�����顢�춡�黥Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����CH3OH(l)+O2(g )= CO(g)+2H2O(g) ��H= - 354.8 kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H= -566.0 kJ��mol-1
��H2O(g) = H2O(l) ��H= -44.0 kJ��mol-1
��д���״���ȫȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��______________________________��
��2��ijʵ��С������H2��g����O2��g����KOH��aq����Ƴɵ��װ�ã�װ�â�ͨ��װ�â�ʵ�������϶�ͭ��
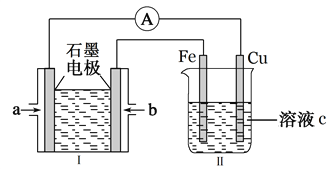
��װ�â��У�a��ͨ�������Ϊ____________������H2������O2�������ŵ�ʱ����Һ�е�K+��______���ƶ������������������������õ�ظ����ĵ缫��ӦʽΪ______________________��
��װ�â��У���Һc��ѡ��________________��Һ��
����ƽ�����װ������Fe�缫�������ı���12.8g����װ�������������������������Ϊ________L����״���£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ����������һ���������ĵ�λ
A.Ħ������B.���ʵ���C.����D.���ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ����ӵ�������˵����ȷ����
A.�����ӵ�������һ��������û�е�λ
B.�����ӵ���������6.02��1023mol-1
C.�����ӵ�������ֵ�ϵ���0.012Kg C������̼ԭ����
D.�����ӵ�������ָ1mol���κ����Ӽ������к��е�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40gmL��1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������ 1 120mL����״��������Ӧ�����Һ�м���1.0molL��1NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ����
A. �õ�2.54 g����ʱ������NaOH��Һ�������640 mL
B. ��Ũ������HNO3�����ʵ���Ũ����14.0 molL��1
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. �úϽ���ͭ��þ�����ʵ���֮����1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ػ��������ɫ��Ӧ����ɫ�ܲ����۲죬���ֵ���ɫ��
A.��ɫB.��ɫC.��ɫD.��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������������ֲ���6���ǣ� ��
A.��NaCl�����У���һ��Na+������Ҿ�����ȵ�Cl���ĸ���
B.�ڽ��ʯ�����У���С�Ļ��ϵ�̼ԭ�Ӹ���
C.�ڶ������辧���У���С�Ļ��ϵ�ԭ�Ӹ���
D.��ʯī�����Ƭ��ṹ�У���С�Ļ��ϵ�̼ԭ�Ӹ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com