
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①CH3OH(l)+O2(g )= CO(g)+2H2O(g) △H= - 354.8 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
请写出甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________。
(2)某实验小组利用H2(g)、O2(g)、KOH(aq)设计成电池装置(装置Ⅰ),通过装置Ⅱ实现铁棒上镀铜。
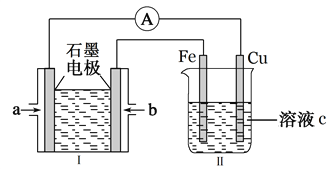
①装置Ⅰ中,a口通入的气体为____________(填“H2”或“O2”),放电时,溶液中的K+向______极移动(填“正”或“负”),该电池负极的电极反应式为______________________。
②装置Ⅱ中,溶液c可选用________________溶液。
若电镀结束后,装置Ⅱ中Fe电极的质量改变了12.8g,则装置Ⅰ中理论上消耗氧气的体积为________L(标准状况下)
【答案】 2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6 kJ·mol-1 O2 正 H2-2e-+2OH-===2H2O CuSO4 2.24
【解析】(1)①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJmol-1,②2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1,③H2O(g)═H2O(l)△H=-44.0kJmol-1,根据盖斯定律,将①×2+②+③×4得到2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l),所以该反应的△H=(-354.8kJ/mol)×2 +(-566.0kJ/mol) +(-44.0kJ/mol)×4=- 1451.6kJmol-1,即2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6kJmol-1,故答案为:2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l)△H=-1451.6kJmol-1;
(2)①根据图示,装置I为氢氧燃料电池,装置II为电解池,通过装置Ⅱ实现铁棒上镀铜,则铁作阴极,即b为负极,则b极上通入氢气,a口通入氧气;放电时,溶液中的K+向正极移动,负极的电极反应式为H2-2e-+2OH-=2H2O,故答案为:O2;正;H2-2e-+2OH-===2H2O;
②装置Ⅱ为电镀池,实现铁棒上镀铜,溶液c可选用硫酸铜溶液,电镀结束后,Fe电极的质量改变了12.8g,为析出的铜,物质的量为![]() =0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。
=0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。


科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应逆反应的△H_____0(填“<”“>”“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。则6s时c(A)=_____________,C的物质的量为_____________;若反应经一段时间后,达到平衡时A的转化率为_______________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ___________________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为____________。
A(g)+B(g)的平衡常数的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
下列说法不正确的是
A. “还原”后可以用KSCN检验Fe3+是否反应完全
B. “还原”时反应Ⅱ的离子方程式为2Fe3+ + FeS2 = 2S↓+ 3Fe2+
C. “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3
D. 所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 含有共价键的化合物一定是共价化合物
B. 气态单质分子中一定存在共价键
C. 含有离子键的化合物一定是离子化合物
D. 含有离子键的化合物不一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.用金属钠可区分乙醇和乙醚B.用高锰酸钾酸性溶液可区分己烷和3-己烯
C.用水可区分乙醇、甲苯、硝基苯D.用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是
A. Fe3+、Cu2+、Cl-、NO3- B. H+、Na+、HSO3-、CO32-
C. Ca2+、Fe2+、SO42-、ClO- D. Mg2+、NH4+、OH-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol/L的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000molL的KCl、KBr及KI溶液,其滴定曲线入下图,(已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17),下列说法正确的是

A. V0= 45.00
B. 滴定曲线①表示KCl的滴定曲线
C. 滴定KCl时,可加入少量的KI作指示剂
D. 当AgNO3溶液滴定至60.00mL 时,溶液中 c(I-)-)-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、CO ![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( ) ①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( ) ①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
A.①②④②③
B.④②①②③
C.①②③②④
D.④②③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com