
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是

A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜右侧向左侧迁移
B. 可用湿润的淀粉KI试纸检验气体M
C. 石墨极的电极反应式为NH4++3Cl--6e-= NCl3 +4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
【答案】C
【解析】
A、根据图示信息知道:石墨电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,每生产1molNCl3,理论上有6molH+经质子交换膜由右侧向左侧迁移,选项A错误;
B、Pt是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,不可用湿润的淀粉KI试纸检验氢气,选项B错误;
C、石墨电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,选项C正确;
D、电解过程中,质子交换膜右侧电极上发生的电极反应:NH4++3Cl--6e-=NCl3+4H+,每生产1molNCl3同时生成4molH+,理论上有6molH+经质子交换膜由右侧向左侧迁移,右侧溶液的c(H+)减小,pH增大,选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。

(1) 装置A中发生反应的化学方程式为___________。
(2) 装置D中试管口放置的棉花应浸一种溶液,这种溶液是______,其作用是___________。
(3) 装置B的作用是贮存多余的气体,当D处有明显的现象后,关闭旋塞K,移去酒精灯, 但由于余热的作用,A处仍有气体产生,此时B中现象是____。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲、乙两同学分别设计如下装置来 制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
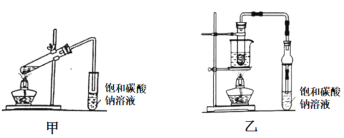
(1)甲装置中右边导管未插入溶液中的目的是 _________。
(2)实验结束后分离出乙酸乙酯的操作是______,必须用到的玻璃仪器有_______(填序号)。
A. 烧杯 B. 容量瓶 C. 分液漏斗 D. 蒸馏烧瓶
(3)乙装置优于甲装置的理由________ (写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有机物X的分子式为C4H8O2,其红外光谱如图所示:
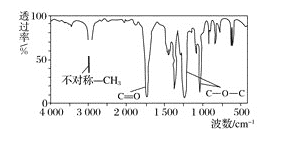
则该有机物可能的结构为_______(任写一种符合题意的即可)。
(2)有机物Y的结构可能有![]() 和
和![]() 两种,要对其结构进行物理方法鉴定,可用_______。有机物Y若为
两种,要对其结构进行物理方法鉴定,可用_______。有机物Y若为![]() ,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应有_____个峰。有机物Y若为
,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应有_____个峰。有机物Y若为![]() ,则红外光谱中应该有_____个振动吸收;核磁共振氢谱中应有_____个峰。
,则红外光谱中应该有_____个振动吸收;核磁共振氢谱中应有_____个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
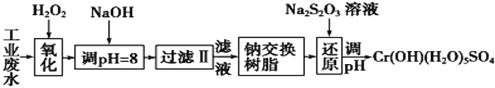
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是____(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是____(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8gCr2O72-转移4.8 mol e-,该反应离子方程式为____。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应是Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
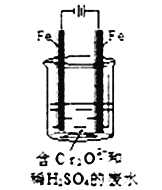
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA气体和1molB气体混合于固定容积为2L的密闭容器中,发生反应:3A(g)+B(g)C(g)+2D(g)。2min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
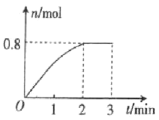
A.当混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢
C.从2min到3min过程中,气体所占的压强不会变化
D.反应过程中A和B的转化率之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com