
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 应前2min的平均速率v(Z)=2.0x10-3mol(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【答案】C
【解析】A、2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)=![]() =0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),选项A错误;B、该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),选项B错误;C、由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
=0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),选项A错误;B、该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),选项B错误;C、由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
X(g)+Y(g)2Z(g)
开始(mol):0.16 0.16 0
变化(mol):0.06 0.06 0.12
平衡(mol):0.1 0.1 0.12
由于反应气体氢气的化学计量数相等,用物质的量代替浓度进行计算,故化学平衡常数k=![]() =1.44,选项C正确;D、再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,选项D错误。答案选C。
=1.44,选项C正确;D、再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32—+O2+x M===Fe3O4+S4O62—+2H2O,有关说法正确的是 ( )
A. 每转移3mol电子,有1.5mol Fe2+被氧化
B. M为OH—离子,x=2
C. O2、S2O32—都是氧化剂
D. 每生成1molFe3O4,反应中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去,其主要反应如下:
① NH3(aq)+ HClO(aq)═ NH2Cl(aq)+ H2O(l)
② 2NH2Cl(aq)+ HClO(aq)═ N2(g)+ H2O(l)+ 3HCl(aq)
(1)在其他条件不变的情况下,向一定量废水中逐滴滴加次氯酸钠溶液,氨氮去除率随n(NaClO)/n(NH3)的变化曲线如下:
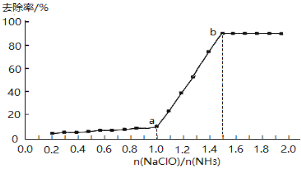
Ⅰ.物质NH2Cl中氮元素的化合价是____________。
Ⅱ.a-b点间,溶液中氨氮去除率迅速提高的原因是__________。
(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是__________。
Ⅱ.实验测得,废水中pH与氨氮去除率如图所示:
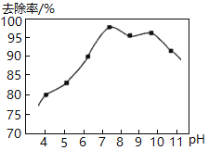
pH较高时,氨氮去除率下降的原因是__________。
pH较低时,氨氮去除率也下降,可能的原因是__________。
(3)运用上述原理去除废水中的氨氮,可结合下图所示的电解法。
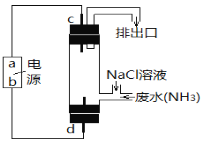
Ⅰ. a极为__________。
Ⅱ. d极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:
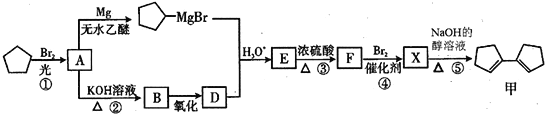
已知: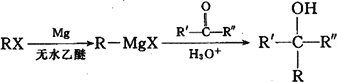 (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_________________。
(2)有机物B的名称是____________,由B→D 所需的反应试剂和反应条件为_______________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式____________________________。
(5)写出同时满足下列条件的甲的同分异构体的结构简式________。
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)![]() CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 molL-1min-1
B. 达平衡时压强变为原来的7/6
C. 此温度下该反应的平衡常数为0.0125
D. 若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下图所示物质相互转换关系

试回答:
(1)写出B的化学式__________,D的化学式__________;
(2)写出由E转变成F的化学方程式__________;
(3)向G溶液中加入A的离子方程式__________;
向G溶液中加入铜片的离子方程式__________;
(4)简述B溶液中阳离子的检验方法__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com