
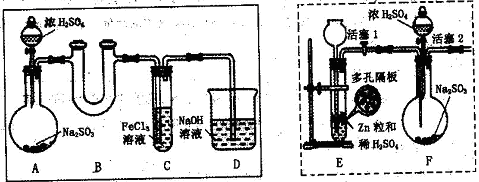
| A.SO2溶解量太小 |
| B.SO2不与Fe3+发生反应 |
| C.H2SO3与BaCl2不反应 |
| D.装置中的空气与SO2进入水中也可生成H2SO4 |


科目:高中化学 来源:不详 题型:填空题
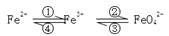
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述I | 陈述II | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
| C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
| D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 : 2 | B.3 : 5 | C.4 : 3 | D.3 : 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最后得到的溶液中不含有Cu2+ | B.残余固体一定全部是铜 |
| C.最后得到的溶液中只含Cu2+ | D.残余固体可能为铁、铜混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
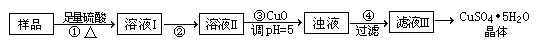
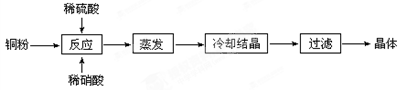
| A.醋酸 | B.草酸 | C.苯甲酸 | D.苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②④⑤ | C.①③⑥ | D.①②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+ |
| B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+ |
| C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快 |
| D.溶液中出现的黑色物质可能是氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com