
【题目】钾(K)资源丰富,成本低廉,用其制作的钾离子电池有着超越锂离子电池的发展前景。我国科研人员在钾离子电池的研发上做出了巨大的贡献。如图是我国某科研团队研制的一种钾离子电池充电时的示意图,下列说法不正确的是( )

A.放电时,外电路电子由电极a流向电极b
B.钾离子电池电解液一般选择有机溶剂,但会有一定的安全隐患
C.充电时,每当外电路中转移1mole-,正极材料会“释放”39gK+
D.充电时,电极b上的电极反应式为:WS2+xK++xe-=KxWS2
【答案】A
【解析】
该电池充电过程中,K+由类普鲁士蓝物移向WS2层状物中,由此可知,电极a发生氧化反应,电极b发生还原反应,充电过程中,电极a为阳极,电极b为阴极,放电过程中,电极a为正极,电极b为负极,以此解答。
A.由上述分析可知,放电时,电极b为负极,发生氧化反应,电极a为正极,发生还原反应,因此外电路电子由电极b流向电极a,故A符合题意;
B.钾离子电池电解液基本沿用锂离子电池电解液体系,钾盐主要有六氟磷酸钾(KPF6)、双氟磺酰亚胺钾(KFSI)等,常见的溶剂有碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)等,其有机易燃电解质在循环过程中会带来安全威胁,热失控的可能性被认为是引起安全问题的主要问题,故B不符合题意;
C.充电时,原正极材料发生氧化反应“释放”K+,K+带1个单位正电荷,每当外电路中转移1mole-,正极材料会“释放”1molK+(即39gK+),故C不符合题意;
D.充电时,电极b为阴极,WS2发生还原反应,电极反应式为:WS2+xK++xe-=KxWS2,故D不符合题意;
故答案为:A。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是
A. 含有两种溶质 B. 只含有一种溶质
B. 只含有一种溶质 C. 只含有碳酸钠
C. 只含有碳酸钠 D. 有碳酸钠和碳酸氢钠
D. 有碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酸乙酯常用于合成人造香料,其合成路线如图所示(部分反应条件略去):
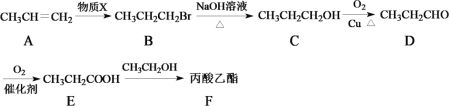
(1)化合物B的分子式是___________,化合物C中含氧官能团的名称为___________。
(2)E→F的化学反应方程式是___________,反应类型是___________。
(3)A→B的反应是加成反应,则物质X的化学式为___________。
(4)E→F转化中有多种有机副产物,其中一种副产物Q的相对分子质量为74,氢的质量分数为13.51%,分子中碳氢原子个数比是2∶5,则Q的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
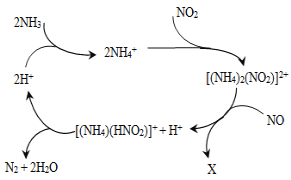
A.X是N2
B.NH![]() 中含有非极性共价键
中含有非极性共价键
C.NH3、NH![]() 、H2O中的质子数、电子数均相同
、H2O中的质子数、电子数均相同
D.上述历程的总反应为:2NH3+NO+NO2![]() 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—E为常见的有机物。以A为原料合成化合物E,其合成路线如图1所示。已知:A的产量通常用来衡量一个国家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
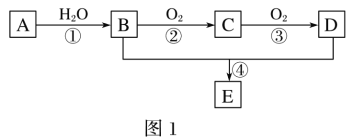
(1)A的分子式______。
(2)A中官能团的名称是_____;B中官能团的结构简式是_____。
(3)反应①的反应类型为_____;反应④的反应类型为_____。
(4)反应④的化学方程式为_____。
(5)某学习小组设计B催化氧化的实验装置如图,根据图2装置回答问题。
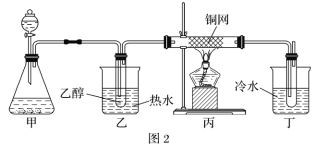
①装置甲锥形瓶中盛放的固体为过氧化钠,请写出甲中反应的化学方程式_____。
②B催化氧化的产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为_____。
③实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接乙醇燃料电池(DEFC) 具有无毒、来源丰富等优点,其装置如下图所示。装置工作时,下列说法错误的是
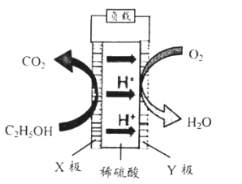
A.化学能转化为电能B.稀硫酸为该电池的电解质溶液
C.电子由Y极流出经负载流向X极D.电池反应为C2H5OH+ 3O2→2CO2+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4 熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3 和 H2O 分子间都可以形成氢键
D.NH4H 是离子化合物,其含有离子键、极性键、非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2 ![]() TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
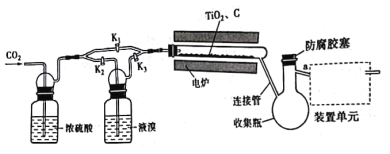
A.开始反应时,活塞的状态为K1关闭,K2,K3打开
B.为防止连接管堵塞,反应过程中需微热连接管
C.为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D.反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
第四周期 | ⑩ |
(1)在这些元素中,化学性质最活泼的是___;化学性质最不活泼的是___(填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子___,④和⑧结合的化合物的电子式是___,该化合物属于___化合物(填“共价”或“离子”)。
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是___(用化学式表示),⑥、⑦、⑧三种元素的非金属性逐渐___,①、④、⑩三种元素原子还原性逐渐___(填“增强”或“减弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com