
【题目】下列叙述正确的是
A.胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有
B.同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同
C.原子结构模型演变历史可以表示为:

D.借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
【答案】D
【解析】
A、胶体与其它分散系的本质区别是分散质微粒大小,故A错误;
B、同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同,也可能是因为气体分子数不同,故B错误;
C、1803年道尔顿模型,原子是一个坚硬的实心小球;1904年汤姆生(J.J.Thompson)模型,原子是一个带正电荷的球,电子镶嵌在里面,原子好似一块“葡萄干布丁”;1911年卢瑟福提出行星模型,原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转;1913年玻尔模型,电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量。提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔,故C错误;
D、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素,故D正确;
故选D。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合肼法制备叠氮化钠的工艺流程如图所示:
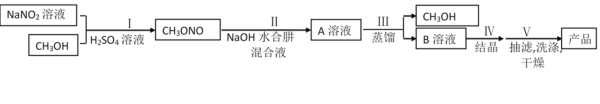
一、合成水合肼
己知:![]() (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。![]() (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
合成![]() 的装置如图1所示。
的装置如图1所示。![]() 碱性溶液与尿素
碱性溶液与尿素![]() 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出![]() 的结构式____________,
的结构式____________,![]() 的电子式____________
的电子式____________
(2)①写出制取![]() 的离子方程式___________________________
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________理由是_______________图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出![]() ,应该采用的分离方法最合理的是________。
,应该采用的分离方法最合理的是________。
二、合成叠氮化钠(![]() )晶体
)晶体
已知:相关物质的物理性质如下表
熔点℃ | 沸点℃ | 溶解性 | |
| -97 | 67.1 | 与水互溶 |
水合肼( | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯( | -17 | -12 | 溶于乙醇、乙醚 |
NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
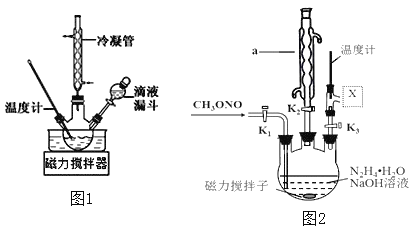
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________。(写出1点即可)
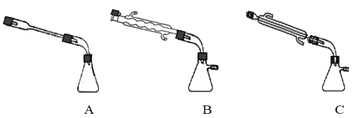
②图中![]() 处连接的最合适装置应为下图中的__________。
处连接的最合适装置应为下图中的__________。
③步骤Ⅱ中制备叠氮化钠的操作是________(填序号)步骤Ⅲ中溶液![]() 进行蒸馏的合理操作顺序是_______。(填序号)
进行蒸馏的合理操作顺序是_______。(填序号)
①打开![]() ,关闭
,关闭![]() ②打开
②打开![]() ③加热 ④关闭
③加热 ④关闭![]()
(4)步骤Ⅳ对溶液![]() 加热蒸发至溶液体积的
加热蒸发至溶液体积的![]() ,
,![]() 结晶析出。步骤Ⅴ可以用________洗涤晶体。
结晶析出。步骤Ⅴ可以用________洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
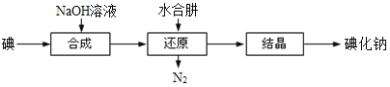
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.  吸收HCl气体,并防止倒吸
吸收HCl气体,并防止倒吸
B. ![]() 准确量取一定体积K2Cr2O7标准溶液
准确量取一定体积K2Cr2O7标准溶液
C.  制备碳酸氢钠
制备碳酸氢钠
D. 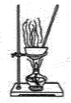 蒸干FeCl3溶液制备无水FeC13
蒸干FeCl3溶液制备无水FeC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新合成的某有机物A的结构简式如图,它含有1个手性碳原子,具有光学活性。若要使A通过反应失去光学活性,则发生的反应类型不可能是( )

A. 酯化反应 B. 水解反应 C. 银镜反应 D. 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知将1mol SO2(g)氧化为1mol SO3(g)的 ΔH=-99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知将1mol SO2(g)氧化为1mol SO3(g)的 ΔH=-99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________。
(2)图中△H=____________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com