
【题目】工业水合肼法制备叠氮化钠的工艺流程如图所示:
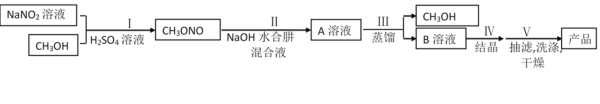
一、合成水合肼
己知:![]() (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。![]() (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
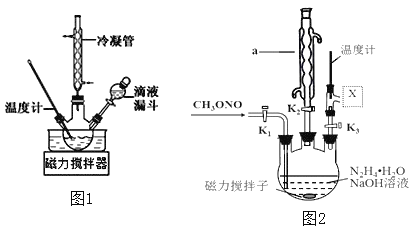
合成![]() 的装置如图1所示。
的装置如图1所示。![]() 碱性溶液与尿素
碱性溶液与尿素![]() 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出![]() 的结构式____________,
的结构式____________,![]() 的电子式____________
的电子式____________
(2)①写出制取![]() 的离子方程式___________________________
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________理由是_______________图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出![]() ,应该采用的分离方法最合理的是________。
,应该采用的分离方法最合理的是________。
二、合成叠氮化钠(![]() )晶体
)晶体
已知:相关物质的物理性质如下表
熔点℃ | 沸点℃ | 溶解性 | |
| -97 | 67.1 | 与水互溶 |
水合肼( | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯( | -17 | -12 | 溶于乙醇、乙醚 |
NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________。(写出1点即可)
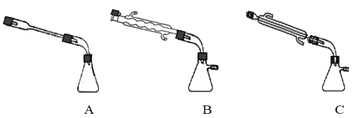
②图中![]() 处连接的最合适装置应为下图中的__________。
处连接的最合适装置应为下图中的__________。
③步骤Ⅱ中制备叠氮化钠的操作是________(填序号)步骤Ⅲ中溶液![]() 进行蒸馏的合理操作顺序是_______。(填序号)
进行蒸馏的合理操作顺序是_______。(填序号)
①打开![]() ,关闭
,关闭![]() ②打开
②打开![]() ③加热 ④关闭
③加热 ④关闭![]()
(4)步骤Ⅳ对溶液![]() 加热蒸发至溶液体积的
加热蒸发至溶液体积的![]() ,
,![]() 结晶析出。步骤Ⅴ可以用________洗涤晶体。
结晶析出。步骤Ⅴ可以用________洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
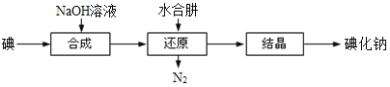
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________。
【答案】![]()
![]() ClO- +CO(NH2)2 +2OH- = Cl- +N2H4·H2O+ CO32- NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 减少(防止)水合肼挥发 减压蒸馏 20℃冷水浴 (或 缓慢通入CH3ONO 气体 ) C ① ④②③ 或 ②④③ D N2H4H2O的氧化产物为N2和H2O ,不引入杂质 (分离产品过程容易进行)
ClO- +CO(NH2)2 +2OH- = Cl- +N2H4·H2O+ CO32- NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 减少(防止)水合肼挥发 减压蒸馏 20℃冷水浴 (或 缓慢通入CH3ONO 气体 ) C ① ④②③ 或 ②④③ D N2H4H2O的氧化产物为N2和H2O ,不引入杂质 (分离产品过程容易进行)
【解析】
(1)N2H4为共价化合物,有氮与氮之间,氢与氮之间均存在共价单键,满足稳定结构,;NaClO为离子化合物,由钠离子与次氯酸根离子构成;
(2)①![]() 碱性溶液与尿素
碱性溶液与尿素![]() 反应制备
反应制备![]() ;
;
②根据已知信息,![]() 易被氧化,考虑滴液漏斗滴加试剂;根据实验目的及冷凝管的用途,再结合
易被氧化,考虑滴液漏斗滴加试剂;根据实验目的及冷凝管的用途,再结合![]() 的物理特性,分析冷凝管的作用;
的物理特性,分析冷凝管的作用;
③对于互溶的液体混合物,可利用沸点不同进行蒸馏操作分离混合物;
(3)①控制反应的温度尽量在20℃左右;
②为避免产物的残留,X应连接冷凝管且应为直形冷凝管;
③步骤Ⅱ中制备叠氮化钠的操作打开K1通入亚硝酸甲酯,打开K2与大气相通,并使由于反应热而变成气体的反应物冷凝成液体流回烧瓶,同时要关闭K3,据此分析;
(4)根据亚硝酸甲酯的物理性质作答;
(5)N2H4H2O的氧化产物为N2和H2O。
(1)N2H4为共价化合物,有氮与氮之间,氢与氮之间均存在共价单键,满足稳定结构,其结构式为:![]() ;NaClO为离子化合物,由钠离子与次氯酸根离子构成,其电子式为:
;NaClO为离子化合物,由钠离子与次氯酸根离子构成,其电子式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(2)①依据题意可知,![]() 碱性溶液与尿素
碱性溶液与尿素![]() 发生氧化还原反应,其离子方程式为:ClO- +CO(NH2)2 +2OH- = Cl- +N2H4·H2O+ CO32-,
发生氧化还原反应,其离子方程式为:ClO- +CO(NH2)2 +2OH- = Cl- +N2H4·H2O+ CO32-,
故答案为:ClO- +CO(NH2)2 +2OH- = Cl- +N2H4·H2O+ CO32-;
②因NaClO具有强氧化性,过量的NaClO溶液会将水合肼氧化,所以滴液漏斗中需要缓慢滴入的是![]() 碱性溶液,要制备的水合肼沸点118.5℃,所以冷凝管可减少(防止)水合肼挥发;
碱性溶液,要制备的水合肼沸点118.5℃,所以冷凝管可减少(防止)水合肼挥发;
故答案为:NaClO碱性溶液;防止过量的NaClO溶液将水合肼氧化;减少(防止)水合肼挥发;
③因水合肼和水互溶,且沸点不同,所以可采用减压蒸馏的方法分离水合肼,
故答案为:减压蒸馏;
(3)①实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,所以要控制反应的温度尽量在20℃左右,或使反应慢慢进行,减少因反应放热温度的升高,故答案为:20℃冷水浴 (或缓慢通入CH3ONO气体);
②X应连接冷凝管且应为直形冷凝管,不能用球形冷凝管,避免产物的残留,故选C,
故答案为:C;
③步骤Ⅱ中制备叠氮化钠的操作打开K1通入亚硝酸甲酯,打开K2与大气相通,并使由于反应热而变成气体的反应物冷凝成液体流回烧瓶,同时要关闭K3,故选①,
故答案为:①;
(4)根据亚硝酸甲酯的物理性质中能溶于乙醇、乙醚,水合肼与水或醇互溶,不溶于乙醚和氯仿,所以应选项乙醇对产品进行洗涤,故选D,
故答案为:D;
(5)N2H4H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,故答案为:N2H4H2O的氧化产物为N2和H2O,分离产品过程容易进行,
故答案为:N2H4H2O的氧化产物为N2和H2O ,不引入杂质 (分离产品过程容易进行)。


科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置探究氨气的性质。

请回答:
(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是____________________。
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显______(填字母)。
a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是_________________________________。
(4)①、②中的现象说明氨气能与______(填化学式)发生化学反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,在2L的密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ![]() cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
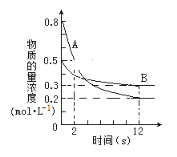
(1)化学计量数b:c=_______
(2)前12s内,A的平均反应速率为________________
(3)12s内,A和B反应放出的热量为__________
Ⅱ.已知:Cu+2FeCl3=2FeCl2+CuCl2利用这一反应,试设计一个原电池,指出电极材料名称,并写出电极反应式
正极:__________ 电极反应:__________________
负极:__________ 电极反应:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及所得出的结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
① | 用玻璃棒蘸取次氯酸钠溶液,点在 | 试纸最终显蓝色 | 次氯酸钠溶液显碱性 |
② | 向废 | 未出现红色固体 | X中一定不含 |
③ | 将 | 白色沉淀变为蓝色沉淀未出现红色固体 |
|
④ | 用 | 迅速产生无色气体 | 形成锌铜原电池加快制取氢气的速率 |
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有
B.同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同
C.原子结构模型演变历史可以表示为:

D.借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com