
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
【答案】3d 配位键 1 sp N>O>C N2 ![]() K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高
K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高 ![]()
【解析】
(1)Fe原子核外有26个电子,失去3e得到Fe3+,基态Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5,电子填充的最高能级为3d,
故答案为:3d;
(2)K4[Fe(CN)6]是离子化合物,存在离子键,其中Fe(CN)![]() 含有共价键和配位键,即化学键为离子键、配位键和共价键;1个Fe(CN)
含有共价键和配位键,即化学键为离子键、配位键和共价键;1个Fe(CN)![]() 中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个
中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个![]() 键、2个
键、2个![]() 键,即1个Fe(CN)
键,即1个Fe(CN)![]() 中含有12个
中含有12个![]() 键,所以含有12molσ键的K4[Fe(CN)6的物质的量为1mol,
键,所以含有12molσ键的K4[Fe(CN)6的物质的量为1mol,
故答案为:配位键;1;
(3)CN中中心原子C的价层电子对数=![]() =2,即CN的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;CN-含有2个原子,价电子数为10,与CN-互为等电子体的分子有氮气,离子有
=2,即CN的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;CN-含有2个原子,价电子数为10,与CN-互为等电子体的分子有氮气,离子有![]() ,
,
故答案为:sp杂化;N>O>C;N2;![]() ;
;
(4)①K和Na都为金属晶体,Li原子半径小于Na原子半径,对核外电子的吸引能力更强,金属键更强,熔点更高;
故答案为:K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高;
②设晶胞的边长为x,则4r=![]() x,则x=
x,则x=![]() cm,晶胞体积V=x3cm3=
cm,晶胞体积V=x3cm3=![]() cm3,该晶胞中Fe原子数为
cm3,该晶胞中Fe原子数为![]() ,m(晶胞)=nM=
,m(晶胞)=nM=![]() ×ag,晶胞密度ρ=
×ag,晶胞密度ρ=![]() =
=![]() g/cm3=
g/cm3=![]() ,
,
故答案为:![]()


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
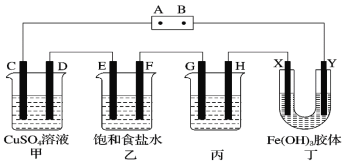
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂污水中含CN-,现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
(5)装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___;其原子核外电子排布的最高能层符号为___。
(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为__。
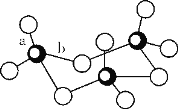
(3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图___;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___。
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是____。(填元素符号)
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___nm,与Ti紧邻的O个数为___。
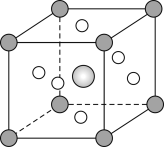
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___位置,O处于___位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关水的电离平衡的说法正确的是( )
A.水的离子积通常用![]() 来表示,只适用于纯水,在稀盐酸中数值会变大
来表示,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.盐溶于水对水的电离平衡均没有影响,水溶液一定呈中性
D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹(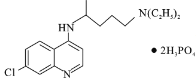 )是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹(
)是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹( )和磷酸在一定条件下制得。氯喹的合成路线如下:
)和磷酸在一定条件下制得。氯喹的合成路线如下:

(1)有机物A的名称是___________,E中含氧官能团的名称是___________。
(2)反应①、②的反应类型分别是___________、___________。
(3)写出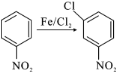 的方程式_______________。
的方程式_______________。
(4)F的结构简式是___________。
(5)反应③的另一种产物为___________。
(6)M是H的一种同分异构体,写出满足下列条件的M的结构简式(不考虑立体异构,只需写出2种)____________________。
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2:1:1:1。
(7)设计由甲苯为起始原料制备 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于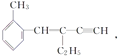 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
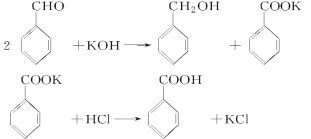
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
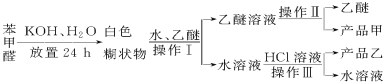
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
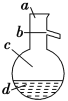
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,收集产品甲的适宜温度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类利用最早的金属之一,其单质及化合物在人生产生活中有着广泛的应用。
(1)铜可以做成导线,Cu的焰色为___________色;基态Cu2+的核外电子占据的最高能层的能层符号为___________。
(2)铜可以作为乙醇和氧气反应的催化剂,2CH3CH2OH + O2![]() CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
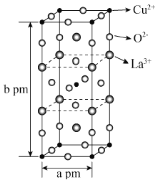
(3)高温超导是世界上最前沿的研究之一,如下图是第一个被发现的高温超导体氧化物的晶胞。该化合物的化学式为___________。与Cu2+紧邻的O2-的个数为___________。已知,阿伏加德罗常数为NA,则晶胞密度为___________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com