
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入25.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点. 其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.04 |
2 | 25.00 | 2.00 | 22.98 |
3 | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
【答案】
(1)①③⑤⑥
(2)乙;偏大
(3)偏大
(4)解:三次滴定耗酸体积分别为20.02mL,20.98mL,19.98mL,其中第二次误差较大,取第一次与第三次平均值为20.00mL,c(NaOH)= ![]() =0.08256mol/L;
=0.08256mol/L;
答:NaOH溶液的物质的量浓度为0.08256mol/L
【解析】解:(1)①锥形瓶装待测液时不能润洗,所以不能用待测NaOH溶液润锥形瓶,故①错误;②锥形瓶用于盛装一定体积的待测液,故②正确;③用石蕊作指示剂,变色不明显,故③错误;④取一支酸式滴定管,洗涤干净,故④正确;⑤酸式滴定管要用标准酸溶液润洗三次,不能直接往酸式滴定管中注入标准酸溶液,进行滴定,故⑤错误;⑥两眼应该注视着锥形瓶中溶液颜色变化,故⑥错误; 所以错误的有①③⑤⑥;
所以答案是:①③⑤⑥;(2)碱性溶液盛放在碱式滴定管中,图中甲为酸式滴定管,乙为碱式滴定管,所以盛放在乙中;取用NaOH溶液开始平视读数、结束时俯视读数,则体积偏大,滴定时消耗的标准溶液的体积偏大,所以所测氢氧化钠溶液浓度偏大;
所以答案是:乙;偏大;(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,则消耗的标准溶液的体积偏大,由c(待测)= ![]() 可知,所测氢氧化钠溶液浓度偏大;
可知,所测氢氧化钠溶液浓度偏大;
所以答案是:偏大;
【考点精析】关于本题考查的酸碱中和滴定,需要了解中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能得出正确答案.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1 的是( )
A.2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2
B.S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2
C.C(s)+ ![]() O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2
D.2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列说法不正确的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次减小
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32﹣)
C.b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH=CHCl可发生的反应有
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性高锰酸钾溶液褪色 ⑥与AgNO3溶液反应得到白色沉淀 ⑦聚合反应,正确的是( )
A.以上反应均可发生
B.只有⑦不能发生
C.只有⑥不能发生
D.只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 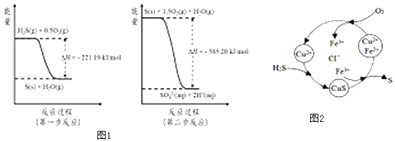
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
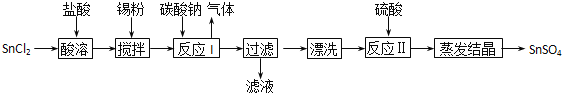
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
(1)SnCl2用盐酸而不用水直接溶解的原因是______,加入Sn粉的作用是_______。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_____________________。
(3)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0molL-1,则应控制溶液pH的范围是________。
(4)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
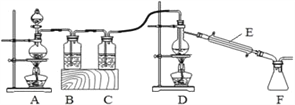
①装置C中应加入试剂为__________;仪器E的名称为__________________。
②反应开始生成SnCl4时,可以熄灭_______(填字母序号)处的酒精灯,理由是______。
③该实验装置设计尚存在缺陷,改进的方法是(包括缺少的仪器、试剂及连接位置等)______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为3 ![]()
![]()
![]() +2H2↑.下列说法不正确的是( )
+2H2↑.下列说法不正确的是( )
A.上述反应属于取代反应
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有4种
D.0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可角电解法制备Mg:MgCl2(熔融) ![]() Mg+C12↑
Mg+C12↑
B.用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO﹣+H2O+CO2═2HClO+CaCO3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com