
【题目】下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_________;元素②形成的最高价氧化物的结构式为________。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_________(填化学式),沸点最高的是__________(填化学式)。
(3)元素⑩在周期表中的位置_________;该元素的单质主要用途________(填一种)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。
(5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。
(6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
【答案】 ![]() O=C=O HF H2O 第四周期IVA族 作半导体 HClO4>H2SO4 Al(OH)3+OH-=AlO2-+2H2O
O=C=O HF H2O 第四周期IVA族 作半导体 HClO4>H2SO4 Al(OH)3+OH-=AlO2-+2H2O ![]()
【解析】根据元素①~⑩在表中的位置可知它们分别是H、C、N、O、F、Na、Al、S、Cl、Ge。(1)元素③形成的单质是氮气,电子式为![]() ;元素②形成的最高价氧化物是二氧化碳,结构式为O=C=O;(2)非金属性越强,氢化物越稳定,②、③、④、⑤元素中F的非金属性最强,形成的氢化物HF热稳定性最强,水常温下是液态,沸点最高的是H2O;(3)Ge元素在周期表中的位置为第四周期IVA族;该元素的单质主要用途是作半导体;(4)氯元素非金属性强于硫元素,非金属性越强,最高价氧化物水化物的酸性越强,则⑧、⑨元素的最高价氧化物的水化物酸性强弱比较为HClO4>H2SO4;(5)⑥、⑦两元素的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,它们之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(6)⑥、⑧两元素结合成化合物是离子化合物硫化钠,用电子式表示⑥、⑧两元素结合成化合物的形成过程为
;元素②形成的最高价氧化物是二氧化碳,结构式为O=C=O;(2)非金属性越强,氢化物越稳定,②、③、④、⑤元素中F的非金属性最强,形成的氢化物HF热稳定性最强,水常温下是液态,沸点最高的是H2O;(3)Ge元素在周期表中的位置为第四周期IVA族;该元素的单质主要用途是作半导体;(4)氯元素非金属性强于硫元素,非金属性越强,最高价氧化物水化物的酸性越强,则⑧、⑨元素的最高价氧化物的水化物酸性强弱比较为HClO4>H2SO4;(5)⑥、⑦两元素的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,它们之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(6)⑥、⑧两元素结合成化合物是离子化合物硫化钠,用电子式表示⑥、⑧两元素结合成化合物的形成过程为![]() 。
。


科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是
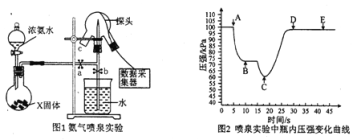
A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 喷泉实验结束后,发现水未充满三颈烧瓶,肯定是因为装置的气密性不好
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈烧瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷水处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g)![]() CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________,此反应的平衡常数为__________________(结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)![]() CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )

A. 若A为醋酸,B为贝壳(粉状),C为澄清石灰水溶液,则C中溶液变浑浊
B. 若A为浓盐酸,B为锌粒,C中盛滴有酚酞的NaOH溶液,则C中溶液褪色
C. 若A为双氧水,B为MnO2,C中为NaOH溶液,D为防倒吸装置
D. 实验中仪器D可起到防倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。
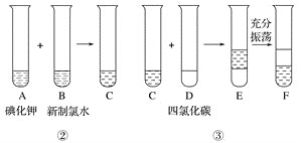
已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1

下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反运的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀。已知高锰酸钾的还原产物是MnO2,则该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com