
 4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).
4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).| 4.53g |
| 906g/mol |
| 2.16g-2.07g |
| 18g/mol |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
| B、电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
| C、未通电前K+向铁极移动,通电后K+还向铁极移动 |
| D、镀锌层破损后对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
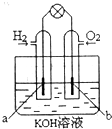 某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com