
����Ŀ����֪���Ը��������Һ���Խ�FeSO4����������ʽΪ2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3
+8H2O���ֽ�һ�����������ữ�ĸ��������Һ������������Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ�������ӵ����ʵ���������KI�����ʵ����ı仯��ϵ����ͼ��ʾ�������й�˵������ȷ���ǣ� ��
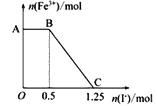
A. ͼ��AB�η������ǹ���������KMnO4��Һ��KI�ķ�Ӧ
B. ͼ��BC�η����ķ�ӦΪ2Fe3++2I-=2Fe2++I2
C. ����OC�ε����ݿ�֪��ʼ����ĸ�����ص����ʵ���Ϊ0.25 mol
D. ��C���Ժ����Һ�м�������KSCN��Һ����Һ���ɫ
���𰸡�D
��������
����A������KI��Һ��AB��Fe3�������ʵ������䣬˵�����������Һ������������Һ��Ӧ�������ع�����A��ȷ��B�����ݵ����غ��֪��������n(KMnO4)Ϊ0.5 mol��5��0.1 mol����������KI��Һ��Fe3�������ʵ������٣�������Ӧ2Fe3����2I��=2Fe2����I2��B��ȷ��C����Ӧ��n(Fe3��)��0.75 mol����������0.75 mol Fe3�����ĵ�n(KMnO4)Ϊ0.75 mol��5��0.15 mol����ʼ����ĸ�����ص����ʵ���0.25 mol��C��ȷ��D��C���Ժ����Һ�в��ٺ���Fe3�� ����������KSCN��Һ����Һ��ɫ���䣬D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ı�����ȷ����(�� ��)
A. NH4++H2O��NH3��H2O+H��
B. Na2SO3+2H2O![]() 2NaOH+2H2SO3
2NaOH+2H2SO3
C. BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
D. NaHCO3��Na++H++CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������÷��У���ȷ����
A. BaCO3�ĵ��뷽��ʽ��BaCO3![]() Ba2++CO32-
Ba2++CO32-
B. ������KI��Һ��ͨ�����(O3)�����ӷ���ʽ�� 2I-+O3+H2O=I2+O2+2OH-
C. ���ˮ�еμӱ����Ȼ�����Һ�õ����ɫҺ��Ļ�ѧ����ʽ��FeCl3+3H2O![]() Fe(OH)3��+3HCl��
Fe(OH)3��+3HCl��
D. ��Ba(OH)2��Һ�е���NaHSO4��Һ��ǡ����ȫ����ʱ����Ӧ�����ӷ���ʽBa2++OH-+SO42-+H+=BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һƿ��ɫ�������Һ��������NH4NO3��KCl��CuCl2��Ba(NO3)2��Na2CO3�е�һ�ֻ������ƶ��ɡ�Ϊ��ȷ�����е����ʣ��ø���Һ������ʵ�飺
��ȡ������Һ���������������������ݲ���
������ٵ���Һ�еμ���������Һ�а�ɫ��������
��ȡԭ��Һ����������NaOH��Һ�����ȣ������̼�����ζ�����壬����ʪ��ĺ�ɫʯ����ֽ�������壬��ֽ����
��1������������ʵ�жϣ��϶����ڵ�������___���϶������ڵ�������___������ȷ���Ƿ���ڵ�������___�����ʵ��֤���Ƿ���ڸ����ʣ�___��
��2��д������ʵ����в����̼�����ζ����ķ�Ӧ�Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11.2g��Ͷ��200mLijŨ�ȵ������У���������ǡ����ȫ��Ӧ����
��1������������HCl�����ʵ���Ũ�ȣ�___
��2����Ӧ�����ɵ�H2�ڱ�״���µ����Ϊ��������___
��3��ȡ100mL��Ũ�ȵ�������100mL5mol/L�����Ͼ��ȣ��ټ�ˮϡ����250mL�����ʱ��������ʵ���Ũ�ȣ�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)19gij���۽������Ȼ���ACl2�к���0.4mol Cl�����ӣ�ACl2��Ħ��������__________________��A�����ԭ��������______________��
(2)1.5mol CO2�к�_____ mol̼ԭ�ӣ�________����ԭ��(��NAΪ�����ӵ�������ֵ)����״���µ����Ϊ___________L��
�� ʵ��������ʯ��ʯ�Ʊ�CO2______________________________________________
�� SO2������NaOH��Ӧ __________________________________________________
��дһ���û���Ӧ����ʽ ______________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �ڴֹ����ȡ�з���2C��SiO2![]() 2CO����Si���豻��ԭ������̼�Ļ�ԭ��ǿ�ڹ�Ļ�ԭ��
2CO����Si���豻��ԭ������̼�Ļ�ԭ��ǿ�ڹ�Ļ�ԭ��
B. ʢ��NaOH��Һʱ��ʹ�ô���������ĥ��ƿ
C. ��SiO2��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��CO2
D. ��Na2CO3��SiO2![]() Na2SiO3��CO2����֪�����������ǿ��̼��
Na2SiO3��CO2����֪�����������ǿ��̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ�������
A. ![]() ��������
��������
B. 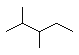 2-��-3-�һ�����
2-��-3-�һ�����
C. ![]() 2-�ǻ�����
2-�ǻ�����
D. 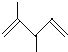 2��3-����-1��4-���ϩ
2��3-����-1��4-���ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Na2CO3�Ļ����Һ�еμ�0.2mol��L-1ϡ���ᣬ����CO2�����ʵ������������������V L���Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
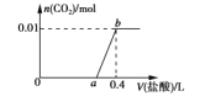
A.��0~a��Χ�ڣ�ֻ�����кͷ�Ӧ
B.ab�η�����Ӧ�����ӷ���ʽΪCO32-+2H+=CO2��+H2O
C.a=0.3
D.ԭ�����Һ��NaOH��Na2CO3�����ʵ���֮��Ϊ6��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com