
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH___(填“大”“小”或“相等”)。
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为____________________。
(3)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为______。
(4)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因:______。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______。
【答案】 小 C2O42->OH->HC2O4- 2CO32-+H2C2O4=2HCO3-+C2O42- CaC2O4(s)![]() Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解 3.2×10-3
Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解 3.2×10-3
【解析】(1)Na2C2O4 和Na2CO3都可以发生两步水解使溶液呈碱性,但是溶液的碱性主由第一步决定,因为碳酸的二级电离常数远小于草酸的二级电离常数,所以相同条件下,碳酸根的水解程度比草酸根大,物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH小。
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,两者恰好反应生成草酸钠溶液,因草酸根发生两步水解且每一步水解都生成氢氧根,所以混合后溶液中阴离子浓度的大小顺序为C2O42->OH- >HC2O4-。
(3)往Na2CO3溶液中加入少量草酸溶液,虽然草酸的酸性比碳酸强,但因草酸不足只能发生2CO32-+H2C2O4=2HCO3-+C2O42-.
(4)患草酸钙结石的病人多饮白开水有利于结石的消融,因为存在沉淀溶解平衡: CaC2O4(s)Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解.
(5)25℃时,向20mL碳酸钙的饱和溶液中,由碳酸钙的Ksp=2.5×10-9可以求出c(Ca2+)=![]() mol/L,逐滴加入c mol/L的草酸钾溶液20mL后,溶液体积变为40mL,c(Ca2+)=2.
mol/L,逐滴加入c mol/L的草酸钾溶液20mL后,溶液体积变为40mL,c(Ca2+)=2. ![]() mol/L,有草酸钙沉淀生成,由草酸钙的Ksp=4.0×10-8,可以求出c(C2O42-)至少为
mol/L,有草酸钙沉淀生成,由草酸钙的Ksp=4.0×10-8,可以求出c(C2O42-)至少为![]() mol/L,则c的最小值为3.2×10-3.
mol/L,则c的最小值为3.2×10-3.


科目:高中化学 来源: 题型:
【题目】如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合. 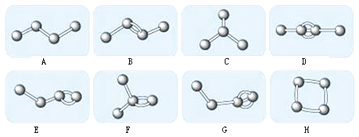
(1)图中属于烷烃的是(填编号)
(2)上图中互为同分异构体的是:A与;B与;D与 . (填编号)
(3)写出H的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A. 0.1mol/LCH3COOH溶液的pH>1:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
B. 用CuCl2溶液做导电性实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
C. 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
D. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 .
A.水
B.稀硫酸
C.溴水
D.酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 .
(3)某同学在学习A的知识后,设计了如下实验.操作步骤为:
①在试管里加入2mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
第④步操作中,铜丝表面的变化是;写出第③步操作中发生反应的化学方程式:
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl-B. Fe3+、H+、I-、HCO3-
C. K+、Na+、NO3-、MnO4-D. Al3+、Mg2+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2、CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 29∶8∶20 B. 22∶1∶15 C. 13∶8∶29 D. 13∶16∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的. 
下列有关说法正确的是( )
A.第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液﹣→过滤后加盐酸
B.从第③步到第⑤步的目的是浓缩、富集溴
C.第①到第⑤步中,涉及到氧化还原反应共有2步
D.第④步中,SO2起氧化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O俗称“莫尔盐”,是一种重要化学试剂,实验室用废铁屑来模拟工业制取莫尔盐,流程如下:

请回答下列问题:
(1)加入10% Na2CO3溶液的作用是_________.
(2)A物质为________.
(3)加少量硫酸调节pH 为1-2 的目的是_______,操作Ⅱ 的名称是________。
(4)根据计算,理论上需加入硫酸铵的质量为_________g .
(5)洗涤潮湿的硫酸亚铁铵晶体所用的试剂最好为___________(填宇母)。
A. 蒸馏水 B. 无水乙醇 C. 稀硫酸 D. 硫酸铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的应用或转化与氧化还原反应原理有关的是( )
A. 工业上用铁矿石炼铁 B. 用稀盐酸除去钢铁表面的铁锈
C. 用胃舒平(氢氧化铝)治疗胃酸过多 D. 工业上煅烧石灰石制生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com