
��10�֣���ͭ�Ͻ�㷺Ӧ���ں��չ�ҵ�����и�����л��������Ʊ�ͭ�Ļ�����Ʒ�������£�
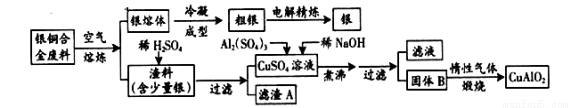
(ע��Al��OH��3��Cu��OH��2��ʼ�ֽ���¶ȷֱ�Ϊ450���80�棩
��1������A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ���������ɫ�Ļ�ѧ����ʽΪ ��
��2����������B�����Ϊ �������ɹ���B�Ĺ����У������NaOH�ļ���������NaOH�����������������ķ�Ӧ�����ӷ���ʽΪ ��
��3������ͭ�Ͻ���ͭ����������Ϊ63.5%��������5.0kg�����е�ͭ����ȫת��Ϊ____mol CuAlO2��Cu �����ԭ����ȡ63.5����������Ҫ1.0mol��L��1��Al2��SO4��3��Һ L��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣�������ᴿ�������������е��Թ㷺Ӧ�ã��������������С�⣺
�����������õ�ˮ����ԭˮ�������á�ԭˮ�к�����ɳ���������ϸ�������ʡ���ͥ������ˮ�ɾ������µľ������裺
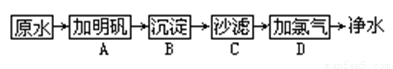
��1�����Գ�ȥ������������ʵIJ�����_____________��
��2��������ɱ���IJ�����___________��
�������в��������в�������Щ������ᴿ�ķ�����
�ٷ���ʳ����̼��ƻ���__________________________________��
�ڴ���ˮ����ȡ�����壨��������������ƣ���_________________��
�����ʱ��߾ƵĶ�����_____________���ܹŴ����Σ�___________________��
�ݳ��ú�ˮ������_______________________������ˮ���룺___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ������ѧ��10�½β⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��11P+15 CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4���йظ÷�Ӧ������˵������ȷ����
A���������ͻ�ԭ�������ʵ���֮��Ϊ15:11
B��������Ӧ��ת�Ƶ��ӵ�����Ϊ15
C��Cu3P���������������ǻ�ԭ����
D��1molCuSO4�μӷ�Ӧʱ��ת�Ƶ���2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
�ٳ�ȥ���������е����������������98%��Ũ����
��ʢ����Լ�ƿ�������ˮ�Լ�����Ļӷ�
�ۼء��ơ�����Ӧ������ˮ��
������ɫ��Ӧʵ��ʱ���ò�˿��ÿ���������ϡ����ϴ�Ӻ���ʹ��
A���٢� B���ڢ� C���٢� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ�ڵ�����ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ȫ��Һ�������һ�����͵���ɫ�������ܵ�ء������ܷ�ӦΪ��
V3++ VO2++H2O VO2++2H++V2+ ����˵����ȷ����
VO2++2H++V2+ ����˵����ȷ����
A���ŵ�ʱÿת��2mol����ʱ������1mol������
B���ŵ�ʱ������ӦΪ��VO+2+2H++e��=VO2++H2O
C���ŵ�����е����ɸ��������·���������������������������Һ����
D���������У�H+������������������Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
����ѧ����ѡ��2����ѧ�뼼������15�֣�
��ͪ�ͱ��Ӷ�����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ���������������������Ӻͱ�ͪ���䷴Ӧ��������ʾ��ͼ���£�

��ػ��������������
���� | ��Է������� | �ܶȣ�g/cm��3�� | �е�/�� |
���� | 94 | 1.0722 | 182 |
��ͪ | 58 | 0.7898 | 56.5 |
����� | 120 | 0.8640 | 153 |
�ش��������⣺
��1����Ӧ�ٺ͢ڷֱ���װ�� �� �н��У���װ�÷��ţ���
��2����Ӧ��Ϊ ������ȡ������ȡ�����Ӧ����Ӧ�¶ȿ�����50��60�棬�¶ȹ��ߵİ�ȫ������ ��
��3���ڷ�Ӧ��A��ͨ���X�� ��
��4���ڷֽ⸪C�м����YΪ����Ũ���ᣬ�������� ���ŵ��������٣�ȱ���� ��
��5���к�D�м����Z�����˵��� �����ţ���֪������һ�����ᣩ
a��NaOH b��CaCO3 c��NaHCO3 d��CaO
��6��������F�е������T��P�ֱ�Ϊ �� ���жϵ������� ��
��7���ø÷����ϳɱ��Ӻͱ�ͪ���ŵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ���ϰ�У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л����������ȷ����
A���Ҵ����ױ��������Ʒ�Ӧ��������
B���춡�������黥Ϊͬ���칹��
C����֬�������ʾ����ڸ߷��ӻ�����
D����ϩ�ͼ������������Ȼ�̼��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����[CO(NH2)2]�����ڵ������������������
A���� B���� C���� D�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ʵ������63%��ŨHNO3 �����ܶ�Ϊ1.4g/mL������240mL 0.50mol/LϡHNO3����ʵ�������У�A��10mL��Ͳ B��50mL��Ͳ C��������ƽ D�������� E��100mL����ƿ F.250mL����ƿ G.500mL����ƿ H����ͷ�ι� I.200mL�ձ���
��1����Ũ��������ʵ���Ũ��Ϊ mol/L
��2��Ӧ��ȡ63%��Ũ���� _________mL��Ӧѡ�� ��������������ĸ��ţ�
��3��ʵ��ʱ����ѡ�õ�������(�����) D��I��
��4�����ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ��� (�����) ��
����ȡŨ�������Ͳ������ˮϴ��2-3�Σ�����ϴ��Һת������ƿ
������ƿʹ��ʱδ����
���ܽ��δ����ȴ����Һ
�ܶ���ʱ��С������������ˮ�ε�ƿ��
�ݶ��ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶���
��5������ƿ��һ�־���ϸ��������ƿ�������侱��ϸ����������������ƿ������Һ��ʱ����Ҫһ�������ĺͼ��ɡ����˽��齫����ƿ��ƿ���Ĵ֣��Ըý������ȷ�����ǣ� ��
A�������˽���Ľ�������ʹ������ƿ
B�����ܰ��˽���Ľ�����Ϊ�ή������ƿ�ľ�ȷ��
C�����ؼӴ�ƿ������Ϊ������ƿ��ת��Һ��ʱ��������Һ�嵹��ƿ�⣬�������Һ��Ũ�Ȳ���̫��Ӱ��
��6��ȡ�����Ƶ�ϡ����100 mL����һ��������ͭ��ַ�Ӧ��ͭȫ���ܽ������NO�����ڱ�״���µ����Ϊ0.224 L������Ӧ����Һ�е�H+Ũ��Ϊ0.1mol/L���跴Ӧ����Һ�������Ϊ100 mL������μӷ�Ӧ��ͭ������Ϊ g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com