
【题目】下列物质均含有氮元素的一组是( )
A. 胆固醇、脂肪酸、油脂 B. 淀粉、半乳糖、磷脂
C. 氨基酸、RNA、脱氧核糖核酸 D. 性激素、唾液淀粉酶、胰岛素
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO (g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+ ![]() O2(g)=H2O(l) △H1 2H2(g)+ O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+ O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ②③④ B. ① C. ④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是
A. Na+ 、Mg2+ 、Cl- 、SO42- B. Na+ 、Ca2+ 、CO32- 、NO3-
C. Na+ 、H+ 、Cl- 、CO32- D. K+ 、Al3+ 、SO42- 、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·xH2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解,草酸钙难溶于水。某研究性小组按照下图装置,检验草酸晶体的分解产物中含有CO、CO2。已知C、E、H中盛装澄清石灰水,D中盛装浓NaOH溶液,G中盛有CuO。

(1)装置B的主要作用是_______。
(2)装置C中反应的离子方程式为_______。
(3)装置D的作用是_______。
(4)装置F所盛的药品是_______。
(5)能证明草酸晶体分解产物中有CO的现象是_______。
(6)H后连接的尾气处理装置为_______。(从“Ⅰ”“Ⅱ”中选择)
(7)为测定草酸晶体分子式(H2C2O4·xH2O) 中x的值,现做如下实验。
①称取6.3 g草酸晶体,将其配置成100.0 mL水溶液为待测溶液;
②取25.0 mL待测溶液放入锥形瓶中,再加入适量的稀硫酸;
③用浓度为0.4 mol/L的KMnO4标准溶液进行滴定,达到滴定终点时,用去12.50 mL KMnO4溶液。
回答下列问题。
写出H2C2O4和酸性KMnO4溶液反应的化学方程式_______;经计算x=_______。
(8)依据以上实验,写出草酸晶体(H2C2O4·xH2O)受热分解的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物
B.一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应
C.一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D.全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2缩聚制得
)和CO2缩聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如生长激素由两条多肽链组成,在生长激素的缩合过程中脱掉的水分子相对分子质量为3 384,已知20种氨基酸的平均分子质量为130,此蛋白质的分子量最接近于 ( )
A. 24 700 B. 21 316 C. 24 440 D. 440180
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH3)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如右图所示:
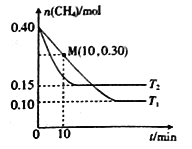
①根据右图判断该反应的△H________0(填“>”、“<”或“=”),理由是______________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=___(保留三位小数)
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________;常温下,将amol·L-1 的HN3与bmol·L-1 的Ba(OH) 2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或“中”)性,溶液中c(HN3)=_________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B. 由C(石墨,s)——C(金刚石,s)△H=+1.9 kJmol-1可知,石墨比金刚石更稳定
C. 在500℃、MPa下,将0.5 mol N2和l.5 mol H2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJmol-1
2NH3(g) △H=-38.6 kJmol-1
D. 甲烷的燃烧热(△H)为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H=-890.3 kJmol-1
CO2(g)+2H2O(g) △H=-890.3 kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com