
【题目】X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】羰基硫是一种有臭鸡蛋气味的无色气体,易燃。常温下,在恒容密闭容器中,将CO和H2S按1:1混合加热可得到羰基硫和氢气。恢复至常温,容器内压强等于反应前的压强。下列说法不正确的是
A.若反应过程转移0.2mol电子,则生成0.1mol羰基硫
B.CO和H2S的反应中,H2S作还原剂
C.羰基硫的化学式为COS,是一种共价化合物
D.1mol羰基硫完全燃烧,消耗1.5mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均含有氮元素的一组是( )
A. 胆固醇、脂肪酸、油脂 B. 淀粉、半乳糖、磷脂
C. 氨基酸、RNA、脱氧核糖核酸 D. 性激素、唾液淀粉酶、胰岛素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示,
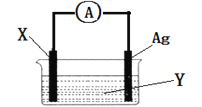
(1)电极X的材料是________________;
电解质溶液Y是_________________;
(2)银电极为电池的______极,发生的电极反应为____________;X电极上发生的电极反应为________________;
(3)外电路中的电子是从____电极流向_____电极。(用电极材料名称作答)
若原来两电极棒质量相等,则当电路中通过0.2mol电子时,两个电极的质量差为__g。
Ⅱ、在一密闭容器中发生反应N2+3H2![]() 2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
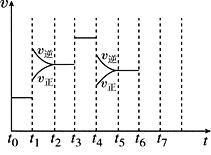
(1)处于平衡状态的时间段是______________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是
t1时刻__________;t3时刻_______;t4时刻_______。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是_______(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。_____
(5)合成氨反应起始只投氮气和氢气,一定条件下,反应达到化学平衡状态时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A. 次氯酸钠溶液可用于环境的消毒杀菌
B. 二氧化硫不可广泛用于食品的增白
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 光化学烟雾是由SO2引起的环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用加入K2Cr2O7氧化剂的办法氧化Na2SO3,现已知1mol K2Cr2O7能把3 mol Na2SO3恰好氧化为Na2SO4,K2Cr2O7被还原为Crn+,则n的值为
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述不正确的是
A. 60g SiO2晶体含4NA个σ键
B. 1mol[Cu(NH3)4]2+中含4NA配位键
C. 在24g石墨中,含C-C共价键数目为6NA
D. CO和N2是等电子体,标况下22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑥氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A. ①③⑥ B. ①②⑤ C. ③⑤⑥ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8、Ksp(AgCl)=4.0×10-10、Ksp(AgBr)=5.0×10-13。下列说法正确的是
A. 由电离常数分析,CH3COOH溶液的pH一定比HClO溶液的pH小
B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH)>c(H+)
C. 25℃时,反应AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=800
AgBr(s)+Cl-(aq)的平衡常数K=800
D. 物质的量浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com