
【题目】化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:
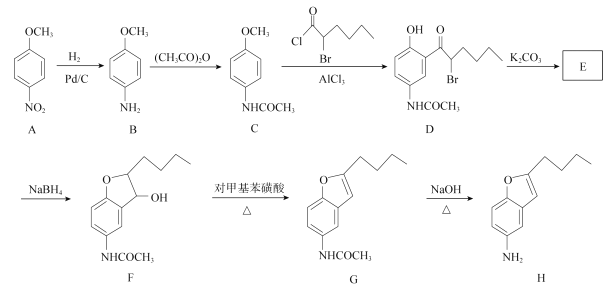
(1))D中的含氧官能团名称为________________(写三种)。
(2)F→G的反应类型为____________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_______________________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子式为C14H17O3N,写出E的结构简式:________________________。
(5)已知:
①苯胺(![]() )易被氧化。
)易被氧化。
②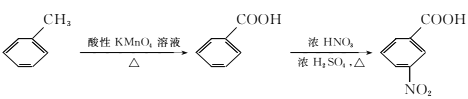
请以甲苯和(CH3CO)2O为原料制备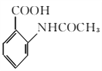 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 ______________________
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 ______________________
【答案】 (酚)羟基、羰基、酰胺键 消去反应 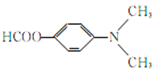 或
或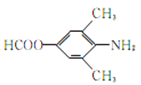 或
或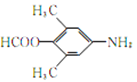
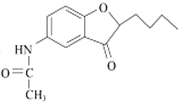
【解析】试题分析:(1))根据D的结构简式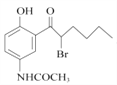 ,分析含氧官能团名称。
,分析含氧官能团名称。
(2) 去掉了羟基,引入碳碳双键。
去掉了羟基,引入碳碳双键。
(3)①能发生银镜反应,说明含有醛基;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应,说明水解产物含有酚羟基;③分子中只有4种不同化学环境的氢,说明苯环上的取代基是对称的。
同时满足条件的 的同分异构体的结构简式有
的同分异构体的结构简式有 或
或 或
或 ;
;
(4)E经还原得到F,结合D的结构简式 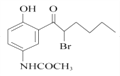 ,可推出E的结构简式。
,可推出E的结构简式。
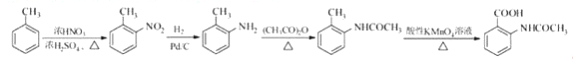
(5)由于苯胺易氧化,甲苯先与浓硫、浓硝酸发生取代反应生成 ,
, 与氢气发生还原反应生成
与氢气发生还原反应生成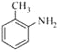 ,
, 与醋酸酐反应生成
与醋酸酐反应生成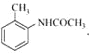 ,
, 再与高锰酸钾反应生成
再与高锰酸钾反应生成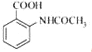 ;
;
解析:(1))根据D的结构简式 ,分析含氧官能团名有羟基、羰基、酰胺键;(2)
,分析含氧官能团名有羟基、羰基、酰胺键;(2) 去掉了羟基,引入碳碳双键,反应类型是消去反应;(3)①能发生银镜反应,说明含有醛基;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应,说明水解产物含有酚羟基;③分子中只有4种不同化学环境的氢,说明苯环上的取代基是对称的;同时满足条件的
去掉了羟基,引入碳碳双键,反应类型是消去反应;(3)①能发生银镜反应,说明含有醛基;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应,说明水解产物含有酚羟基;③分子中只有4种不同化学环境的氢,说明苯环上的取代基是对称的;同时满足条件的 的同分异构体的结构简式有
的同分异构体的结构简式有 或
或 或
或 ;(4)E经还原得到F,结合D的结构简式
;(4)E经还原得到F,结合D的结构简式  ,可推出E的结构简式是
,可推出E的结构简式是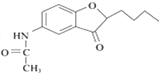 ;(5)由于苯胺易氧化,甲苯先与浓硫、浓硝酸发生取代反应生成
;(5)由于苯胺易氧化,甲苯先与浓硫、浓硝酸发生取代反应生成 ,
, 与氢气发生还原反应生成
与氢气发生还原反应生成 ,
, 与醋酸酐反应生成
与醋酸酐反应生成 ,
, 再与高锰酸钾反应生成
再与高锰酸钾反应生成 ,制备的合成路线流程图是
,制备的合成路线流程图是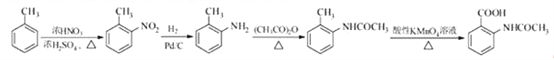 。
。


科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题: 
(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 .
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是;
A.Mg2+
B.Fe2+
C.Al3+
D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如图:回答下列问题: ①操作Ⅰ的名称是 , 操作Ⅱ的名称是 .
②写出在空气中煅烧FeCO3的化学方程式;
(4)有些同学认为KMnO4溶液可以测定亚铁离子含量(5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O). a.称取2.850g绿矾(FeSO47H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL所配溶液于锥形瓶中;
c.加入20.00mL硫酸酸化的0.01mol/LKMnO4溶液恰好完全反应.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 . 定容时俯视刻度线,则c(KMnO4)(填偏大、偏小或不变)
②计算上述样品中FeSO47H2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法不能说明达到化学平衡状态的是
2C(g),下列说法不能说明达到化学平衡状态的是
A. 气体密度不再变化 B. 混合气体的总压强不再变化;
C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 0.2mol/L的Al2(SO4)3中含有n(Al3+)mol,m(SO42﹣)g. 某硫酸钠溶液中含有3.01×1022个Na+ , 则该溶液中SO42﹣的物质的量是mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______________________。

(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是__________。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

由D到A过程中,随着反应的进行反应速率逐渐_________。(填 “加快”或“减慢”),其变化的原因是_____________。(选填字母编号)
A.改变了反应的活化能 B.改变活化分子百分比
C.改变了反应途径 D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
实验编号 | T/K | 催化剂 | 浓度 |
实验1 | 298 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
实验2 | 298 |
① 在实验2中依次填_______________、________________。
② 可得到的结论是浓度越大,H2O2 分解速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是

A. b是阴离子交换膜,允许Na+通过
B. 从A口出来的是H2SO4溶液
C. 阴极反应式为 4OH--4e-=2H2O+O2↑
D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法不正确的是( )
A.分子筛是一种硅酸盐产品,在工业上常用作吸附剂和催化剂
B.生活中常见的汽油、塑料、涂料、木炭、豆油等都属于有机物
C.用维生素C可以除去高锰酸钾污迹,利用了维生素C的还原性
D.苯是一种重要的化工原料,可通过煤的干馏得到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com