
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为_________,其中氮的化合价为__________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为______________。
(3)①2O2(g)+N2(g)= N2O4(l) △H1
②N2(g)+2H2(g)= N2H4(g) △H2
③O2(g)+ 2H2(g)=2H2O(g) △H3
④2 N2H4(g)+ N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=_________,联氮和N2O4可作为火箭推进剂的主要原因为__________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_________(已知:N2H4+H+="==" N2H5+的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为______________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加人联氨溶液,观察到的现象是_______________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_________。
【答案】(1)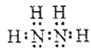 (1分);-2(1分);
(1分);-2(1分);
(2)NaClO+2NH3=N2H4+NaCl+H2O(1分);
(3)2△H3-2△H2-△H1(2分);反应放出热量大、产生大量气体(2分);
(4)8.7×10-7(1分);N2H6(HSO4)2(1分);
(5)固体逐渐变黑,并有气泡产生(2分);N2H4的用量少,不产生其他杂质(1分);(还原产物为N2和H2O,而Na2SO3产生Na2SO4)
【解析】试题分析:(1)联氨是由两种非金属元素形成的共价化合物,电子式为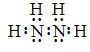 ,根据化合价代数和为零,其中氮的化合价为-2。
,根据化合价代数和为零,其中氮的化合价为-2。
(2)次氯酸钠溶液与氨反应制备联氨,Cl元素的化合价由+1价降低到-1价,N元素的化合价由-3价升高到-2价,根据得失电子守恒和原子守恒配平,反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O。
(3)根据盖斯定律,反应热效应之间的关系式为ΔH4=2ΔH3-2ΔH2-ΔH1。联胺有强还原性,N2O4有强氧化性,两者在一起易发生自发地氧化还原反应,反应放热量大、产生大量气体,所以联氨和N2O4可作为火箭推进剂。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离的方程式为N2H4+H2O![]() N2H5++OH-,已知:N2H4+H+
N2H5++OH-,已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 ;联氨为二元弱碱,酸碱发生中和反应生成盐,则联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2 。
N2H5+的K=8.7×107;KW=1.0×10-14,平衡常数K=8.7×107×1.0×10-14=8.7×10-7 ;联氨为二元弱碱,酸碱发生中和反应生成盐,则联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2 。
(5)联氨是一种常用的还原剂,AgBr具有氧化性,两者发生氧化还原反应生成银,则向装有少量AgBr的试管中加入联氨溶液,可观察到固体逐渐变黑,并有气泡产生;联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,发生的反应为N2H4+O2=N2+2H2O,理论上1kg的联氨可除去水中溶解的氧气为1kg÷32g/mol×32g/moL=1kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是N2H4的用量少,不产生其他杂质,而Na2SO3的氧化产物为Na2SO4。


科目:高中化学 来源: 题型:
【题目】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
A. a>b>c>d B. c>a>b>d C. a>c>d>b D. b>d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)某有机物的结构简式为HOOC—CH=CH-CH2OH。
回答下列问题:
(1)请你写出该有机物所含有的官能团的名称: 。
(2)验证该有机物中含有-COOH官能团常采用的方法和现象: 。
(3)写出该有机物与溴水反应的化学方程式: ,反应类型为 。
(4)该有机物可与乙醇发生酯化反应,写出该反应的方程式: ,请你写出能增大该反应反应速率的一条措施: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣13molL﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13molL﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣13molL﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中常见的几种物质存在如图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C(图中部分产物和反应条件已略去)。
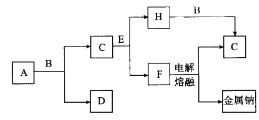
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式:_________。
(2)将ag粉未A加入bmol/L的B的浓溶液cL中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,NA可表示为_____________。
(3)将B的浓溶液与H的浓溶液混合,立即产生大最气体C,该反应的离子方程式为_______。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象: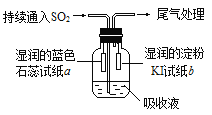
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是_______(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因:_____________
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.海水中提取镁的过程不涉及氧化还原反应
B.海水晒盐的过程发生复分解反应
C.从海水中提取铀等微量元素是海水资源综合利用研究方向之一
D.将明矾加入海水中静置过滤是海水淡化的方法之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com