
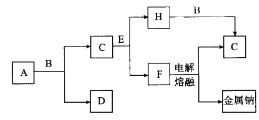
����Ŀ����ѧ��ѧ�г����ļ������ʴ�����ͼ��ʾ��ת����ϵ�����У�A��һ�ֺ�ɫ��ĩ״���壬C��һ�ֻ���ɫ���壬ʵ�����г���E��Һ���ն����C��ͼ�в��ֲ���ͷ�Ӧ��������ȥ����
�ش��������⣺
��1��д��A��B��Ũ��Һ��Ӧ�Ļ�ѧ����ʽ��_________��
��2����ag��δA����bmol/L��B��Ũ��ҺcL�м�����ȫ�ܽ⣬��Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ��NA�ɱ�ʾΪ_____________��
��3����B��Ũ��Һ��H��Ũ��Һ��ϣ�����������������C���÷�Ӧ�����ӷ���ʽΪ_______��
��4��ij����С���ͬѧ��E��Һ����C��������ͼ��ʾװ��������Һ�г���ͨ��SO2���塣
ʵ������й۲쵽��������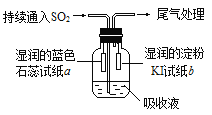
����ʼʱ����Һ�Ϸ����ְ�������ֽa��졣��ͬѧ��Ϊ��HClʹa��죬��ͬѧ��ͬ��Ĺ۵㣬��ͬѧ��Ϊʹa������_______(д��һ�ּ���)��
��Ƭ�̺���Һ�Ϸ����ֻ���ɫ���壬��ֽb�����������ӷ���ʽ����b������ԭ��_____________
��������ֽb��ɫ��ͬѧ����Ϊ���ܵ�ԭ�������֣�һ��I2�л�ԭ�ԣ�����ɫ��������ʽ���������IO3-���Ӷ�ʹ��ɫ��ʧ������_______________��
���𰸡���1��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O(2��)��
MnCl2+Cl2��+2H2O(2��)��
��2��87d/2a(��43.5/d) (2��)��
��3��ClO-+Cl-+2H+=Cl2��+H2O(2��)��
��4����SO2(��H2SO3)(1��)����Cl2+2I-=2Cl-+I2(1��)�����������ԣ�SO2�ܽ�I2��ԭ��I-���Ӷ�ʹ��ɫ��ʧ(2��)
��������
���������C��һ�ֻ���ɫ��������C��������ʵ�����г���E��Һ���ն����C����E������������A��һ�ֺ�ɫ��ĩ״���壬�ܺ�B��Ӧ��������������A�Ƕ������̣�B��Ũ���ᡣ����������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ��F������ڵ��Ȼ��������ƺ����������F���Ȼ��ƣ�H�Ǵ������ƣ��������ƺ����ᷢ��������ԭ��Ӧ����������
��1������������Ũ���ᷴӦ�Ļ�ѧ����ʽΪ MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+ 2H2O��
MnCl2+Cl2��+ 2H2O��
��2����ag��δA����bmol/L��B��Ũ��ҺcL�м�����ȫ�ܽ⣬��Ӧ��Ũ�������������������ȫ��Ӧ������Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ����![]() �����NA��87d/2a��
�����NA��87d/2a��
��3���������ƾ���ǿ�����ԣ�������������������������Ӧ�����ӷ���ʽΪClO��+ Cl��+ 2H+ ��Cl2 ��+H2O��
��4������ΪSO2����ˮ���������ᣬ��Һ�����ԣ�Ҳ��ʹʪ�����ɫʯ����ֽ�Ժ�ɫ��
��Ƭ�̺���Һ�Ϸ����ֻ���ɫ���壬����������������������ǿ�����ԣ��������⻯�����ɵ��ʵ⣬������������ɫ����Ӧ�����ӷ���ʽΪCl2+2I����2Cl��+ I2��
��������ֽb��ɫ����˵�����ʵⱻ��Ӧ�����ʵ�Ⱦ��������ԣ�Ҳ���л�ԭ�ԡ���SO2���л�ԭ�ԣ��ܰ�SO2�����������ᣬ���SO2��I2��ԭ��I�����Ӷ�ʹ��ɫ��ʧ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ۻ������У����ۼ��ļ��������ǣ� ��
A��HCl B��HF C��HBr D��HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳ��£�N2H4����ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϡ��ش��������⣺
��1���������ӵĵ���ʽΪ_________,���е��Ļ��ϼ�Ϊ__________��
��2��ʵ���ҿ��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ______________��
��3����2O2(g)+N2(g)= N2O4(l) ��H1
��N2(g)+2H2(g)= N2H4(g) ��H2
��O2(g)+ 2H2(g)=2H2O(g) ��H3
��2 N2H4(g)+ N2O4(l)=3N2(g)+4H2O(g) ��H4=-1048.9kJ/mol
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4��_________��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ__________��
��4������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ƣ�������һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ_________����֪��N2H4+H+="==" N2H5+��K=8.7��107��Kw=1.0��10-14)�������������γɵ���ʽ�εĻ�ѧʽΪ______________��
��5��������һ�ֳ��õĻ�ԭ������װ������AgBr���Թ��м���������Һ���۲쵽��������_______________�����������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�������ɳ�ȥˮ���ܽ��O2________kg����ʹ��Na2SO3����ˮ���ܽ��O2��ȣ��������ŵ���_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�Ŀ�ͼ�У�A��I�����ɶ�����Ԫ����ɵij������ʡ�����A�����壬����ˮ��Һ�ʼ��ԣ�������D��������F����������ѪҺ�е�Ѫ�쵰��϶�ʹ���ж�������E�����뵼����ϡ�
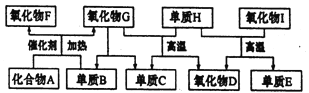
��1��������A�Ļ�ѧʽ��_________��
��2����ɵ���E��Ԫ����Ԫ�����ڱ��е�λ����_________��
H+I��Ӧ�Ļ�ѧ����ʽΪ___________��
��3����״���£���2.24L������F��1.68L����Bͬʱͨ��1L������G�У���Ӧǰ����Һ����ı仯���Բ�������������Һ��pH=__________����ʱ������Һ��ͨ��2.24L������A��������Ӧ��������Һ��pH<7�������ӷ���ʽ��ʾ��ԭ��__________��
��4������B�͵���C��һ�������¿����ԭ��أ���KOH��Һ������ʣ������ԭ��ظ����ĵ缫��ӦʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�����ֶ�����Ԫ�أ�X��Z��������֮����Y����������ȣ�Z�ĵ��Ӳ�����X�ĵ��Ӳ�����2����A��B��C��D��E��F����ѧ��ѧ�еij������ʣ���������������Ԫ���е�һ�֡����ֻ�������ɣ�����A����ʹʪ���ɫʯ����ֽ���������壬D��E�������ᣬF��һ�ֵ��ʣ���Ӧ�ۢ��������������½��У���ת����ϵ��ͼ��ʾ��

�ش��������⣺
��1��A�ĵ���ʽΪ______��
��2��A��E��Ӧ����G��C��G�ж����� ���ѧ�������ͣ���
��3����Ӧ�������ת�Ƶĵ���Ϊ3mol����������AΪ mol��
��4����ѧ�ҷ�����ʹZX3ֱ������ȼ�ϵ�صķ�������װ���ò����缫��������Ե������Һ����һ��ͨ���������һ�缫ͨ��ZX3��ʹ֮ת��Ϊ����Ⱦ�����壬��д�������ĵ缫��Ӧʽ�� ��
��5����Z��X��Ԫ���γɵĺ�10�����ӵ������ӿɺ�XSO4���γ�һ����A������A����Һ�л�������ϡNaOH��Һ����Һǡ�ó����ԣ�����Һ����������Ũ���ɴ�С��˳��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ�ֽ���ѧ��ת��Ϊ���ܵĸ�Ч�������Ѻõķ���װ�ã��õ�صĹ�����ͼ��ʾ�����з����жϴ������

A��a��������b������
B����������������Ӧ
C�������ĵ缫��ӦΪO2+2H2O+2e���T4OH��
D�������ĵ缫��ӦΪH2+2OH����2e���T2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�м�������Na2O2�����ܴ����������������( )
A��K����AlO2-��Cl����SO42-
B��H����Ba2����Cl����NO3-
C��Ca2����Fe2����NO3-��HCO3-
D��Na����Cl����CO32-��SO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com