
����Ŀ��X��Y��Z�����ֶ�����Ԫ�أ�X��Z��������֮����Y����������ȣ�Z�ĵ��Ӳ�����X�ĵ��Ӳ�����2����A��B��C��D��E��F����ѧ��ѧ�еij������ʣ���������������Ԫ���е�һ�֡����ֻ�������ɣ�����A����ʹʪ���ɫʯ����ֽ���������壬D��E�������ᣬF��һ�ֵ��ʣ���Ӧ�ۢ��������������½��У���ת����ϵ��ͼ��ʾ��

�ش��������⣺
��1��A�ĵ���ʽΪ______��
��2��A��E��Ӧ����G��C��G�ж����� ���ѧ�������ͣ���
��3����Ӧ�������ת�Ƶĵ���Ϊ3mol����������AΪ mol��
��4����ѧ�ҷ�����ʹZX3ֱ������ȼ�ϵ�صķ�������װ���ò����缫��������Ե������Һ����һ��ͨ���������һ�缫ͨ��ZX3��ʹ֮ת��Ϊ����Ⱦ�����壬��д�������ĵ缫��Ӧʽ�� ��
��5����Z��X��Ԫ���γɵĺ�10�����ӵ������ӿɺ�XSO4���γ�һ����A������A����Һ�л�������ϡNaOH��Һ����Һǡ�ó����ԣ�����Һ����������Ũ���ɴ�С��˳��Ϊ�� ��
���𰸡���1��![]() ����2�����ۼ������Թ��ۼ�����
����2�����ۼ������Թ��ۼ�����
��3��0.5����4��2NH3-6e-+6OH-=N2+6H2O ����5��c(Na+)��c(SO42-)��c(NH4+)��c(H+)=c(OH-)��
�����������������A��B��C��D��E��F����ѧ��ѧ�еij������ʣ���������������Ԫ���е�һ�֡����ֻ�������ɣ�����A����ʹʪ���ɫʯ����ֽ���������壬��A��NH3��������������F���ʷ�Ӧ����������������������F��O2��X��Y��Z�����ֶ�����Ԫ�أ�X��Z��������֮����Y����������ȣ�Z�ĵ��Ӳ�����X�ĵ��Ӳ�����2������X��HԪ�ء�Z��NԪ�ء�Y��OԪ�أ�D��E�������ᣬF��һ�ֵ��ʣ���Ӧ�ۢ��������������½��У�DΪHNO2��EΪHNO3��������������������NO����B��NO��NO��������������NO2����C��N2����1��ͨ�����Ϸ���֪��A�ǰ�����������Nԭ�Ӻ�ÿ��Hԭ��֮�䶼����һ�����ۼ��������ʽΪ![]() ����2��A�ǰ�����E�����ᣬ���߷�Ӧ����G��GΪNH4NO3��G�к������Ӽ������ۼ���C��NO2�����й��ۼ�������C��G�����м��Թ��ۼ�����3���������������������������������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��2NH3+3O2
����2��A�ǰ�����E�����ᣬ���߷�Ӧ����G��GΪNH4NO3��G�к������Ӽ������ۼ���C��NO2�����й��ۼ�������C��G�����м��Թ��ۼ�����3���������������������������������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��2NH3+3O2![]() 2HNO2+2H2O���÷�Ӧ��ת�Ƶ��ӵ����ʵ���=3mol��4=12mol����Ӧ�������ת�Ƶĵ���Ϊ3mol����������A�����ʵ���n(NH3)=(3mol��12mol)��2=0.5mol����4����������ȼ�ϵ���У������ϰ���ʧ���ӷ���������Ӧ���ɵ�����ˮ�������������õ��Ӻ�ˮ��Ӧ�������������ӣ����Ը����缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O�������缫��ӦʽΪO2+2H2O+4e-=4OH-����5��Z��X��Ԫ���γɵĺ�10�����ӵ���������NH4+���ɺ�HSO4-�γ�һ����A��AΪNH4HSO4������A����Һ�л�������ϡNaOH��Һ����Һǡ�ó����ԣ���Һ�е�������Na2SO4��NH3��H2O��(NH4)2SO4����Һ�����ԣ���c(H+)=c(OH-)�����ݵ���غ��c(Na+)+c(NH4+)=2c(SO42-)�����������狀�NaOH��1��1��Ӧ������Һ�����ԣ�Ҫʹ��Һ�����ԣ�����������Ӧ�������������Ը��������غ��c(Na+)��c(SO42-)��c(NH4+)������Һ����������Ũ���ɴ�С��˳��Ϊ��c(Na+)��c(SO42-)��c(NH4+)��c(H+)=c(OH-)��
2HNO2+2H2O���÷�Ӧ��ת�Ƶ��ӵ����ʵ���=3mol��4=12mol����Ӧ�������ת�Ƶĵ���Ϊ3mol����������A�����ʵ���n(NH3)=(3mol��12mol)��2=0.5mol����4����������ȼ�ϵ���У������ϰ���ʧ���ӷ���������Ӧ���ɵ�����ˮ�������������õ��Ӻ�ˮ��Ӧ�������������ӣ����Ը����缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O�������缫��ӦʽΪO2+2H2O+4e-=4OH-����5��Z��X��Ԫ���γɵĺ�10�����ӵ���������NH4+���ɺ�HSO4-�γ�һ����A��AΪNH4HSO4������A����Һ�л�������ϡNaOH��Һ����Һǡ�ó����ԣ���Һ�е�������Na2SO4��NH3��H2O��(NH4)2SO4����Һ�����ԣ���c(H+)=c(OH-)�����ݵ���غ��c(Na+)+c(NH4+)=2c(SO42-)�����������狀�NaOH��1��1��Ӧ������Һ�����ԣ�Ҫʹ��Һ�����ԣ�����������Ӧ�������������Ը��������غ��c(Na+)��c(SO42-)��c(NH4+)������Һ����������Ũ���ɴ�С��˳��Ϊ��c(Na+)��c(SO42-)��c(NH4+)��c(H+)=c(OH-)��


 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ��ˮ�к���CN����Cr2O72�������ӣ��辭��ˮ������������ŷţ���ˮ�����������������̽��д������ش��������⣺
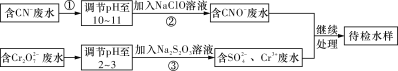
(1)�������У�CN����ClO������ΪCNO�������ӷ���ʽΪ��________________________��
(2)�������ķ�ӦΪS2O32����Cr2O72����H���D��SO42����Cr3����H2O(δ��ƽ)����ÿ����0.4 mol Cr2O72��ת��____________mol e����
(3)��Cr3����ˮ���Լ�����ʯ�ҽ�һ��������Ŀ����_____________________��
(4)��25 ���£���a mol��L��1��NaCN��Һ��0.01 mol��L��1������������ϣ���Ӧ������ҺpH��7����a__________0.01(������������������������)���ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka��______________��
(5)ȡ��ҵ��ˮˮ�����Թ��У�����NaOH��Һ�۲쵽����ɫ�������ɣ������������ٲ�����ɫ����Ϊֹ��������Һ�м�������Na2S��Һ����ɫ����ת���ɺ�ɫ�������ù����з�Ӧ�����ӷ����ǣ�_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A�������Ǵ�����
B����Ȼ���ǿ�������Դ
C��ú�ĸ����ǻ�ѧ�仯
D��ʯ�͵ķ����ѻ����ѽ���ǻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�г����ļ������ʴ�����ͼ��ʾ��ת����ϵ�����У�A��һ�ֺ�ɫ��ĩ״���壬C��һ�ֻ���ɫ���壬ʵ�����г���E��Һ���ն����C��ͼ�в��ֲ���ͷ�Ӧ��������ȥ����
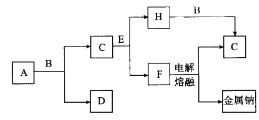
�ش��������⣺
��1��д��A��B��Ũ��Һ��Ӧ�Ļ�ѧ����ʽ��_________��
��2����ag��δA����bmol/L��B��Ũ��ҺcL�м�����ȫ�ܽ⣬��Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ��NA�ɱ�ʾΪ_____________��
��3����B��Ũ��Һ��H��Ũ��Һ��ϣ�����������������C���÷�Ӧ�����ӷ���ʽΪ_______��
��4��ij����С���ͬѧ��E��Һ����C��������ͼ��ʾװ��������Һ�г���ͨ��SO2���塣
ʵ������й۲쵽��������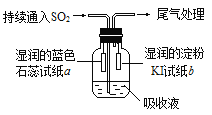
����ʼʱ����Һ�Ϸ����ְ�������ֽa��졣��ͬѧ��Ϊ��HClʹa��죬��ͬѧ��ͬ��Ĺ۵㣬��ͬѧ��Ϊʹa������_______(д��һ�ּ���)��
��Ƭ�̺���Һ�Ϸ����ֻ���ɫ���壬��ֽb�����������ӷ���ʽ����b������ԭ��_____________
��������ֽb��ɫ��ͬѧ����Ϊ���ܵ�ԭ�������֣�һ��I2�л�ԭ�ԣ�����ɫ��������ʽ���������IO3-���Ӷ�ʹ��ɫ��ʧ������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������κ�һ����ѧƽ����ϵ����ȡ���´�ʩ��һ����ʹƽ�ⷢ���ƶ����ǣ� ��
A������һ�ַ�Ӧ�� B��������ϵѹǿ C��ʹ�ô��� D�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������û��Ϸ�Ӧ�ķ����Ƶõ���( )
��SiO2 ��H2SiO3 ��Fe(OH)3 ��CuS ��FeCl2 �� CaSiO3
A���ڢ� B�� �ڢܢ� C���ڢۢܢ� D���ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�����Ҵ������ᡢ��������Һ��ѡ��һ���Լ�����Ϊ�����еģ� ��
A. �������� B. ���� C. �� D. ����������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�����ѧ�ҷ�����һ���¿�������¿�����X��Y��Z��W��R��T��������Ԫ����ɣ�����X��Y��Z�ǽ���Ԫ�أ�W��R��T�Ƿǽ���Ԫ�ء��¿���Ļ�ѧʽ�ɱ�ʾΪX3Y2(ZWR4)3T2����֪X��Zͬ���壬Y��Z��R��Tͬ���ڣ�T�Ƿǽ�������ǿ��Ԫ�أ�Zԭ�ӵ������������������������ȣ�������Rͬ�������һ�����ڱ�Ԫ����Q��QԪ�ص�����������Ӧˮ������ڹ�ҵ����;�㷺����;����ͼ��X��R��ԭ������֮����W��2����
��ش���������
��1��W��Ԫ�����ڱ��е�λ���� ��
��2��Y��Z��R��T����ͬ����Ԫ����ԭ�Ӱ뾶������ ����Ԫ�ط��ű�ʾ����ͬ����
��3��д�������¿���Ļ�ѧʽ�� ��
��4��д���ɼ���XT2��Ӧ��T���⻯��Ļ�ѧ����ʽ ��
��5���ڳ�;�������ʱ������ˮ�м���һ������XR2������XR2��Ŀ����ɱ�������� ��
��6���ɶ�����Ԫ����ɵ�ijЩ���ӣ���SO2��O3��NO�ɻ���Ϊ�ȵ����壬����Zͬ����Ԫ����ɵ������У�����N3����CS2����Ϊ�ȵ������������һ������������������� �������Ҫ�����ӵ����ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�������ᣬ���������Լ���ҽ�÷���������������������һ���Ʊ��������Ƶ�ʵ�鷽�����ش��������⣺
��һ��̼��Ƶ��Ʊ�

��1������ټ��백ˮ��Ŀ����_________________.С����е�������ʹ������������������____________________.
(��)�������Ƶ��Ʊ�
![]() CaCO3
CaCO3![]() ��Һ
��Һ![]()
![]() ��ɫ����
��ɫ����
��2������ڵľ������Ϊ��μ���ϡ���ᣬ����Һ���д����������壬��ʱ��Һ��__________�ԣ���ᡱ��������С���������Һ��У����ȹ��ˡ�����Һ��е�������___________________.
��3��������з�Ӧ�Ļ�ѧ����ʽΪ________________���÷�Ӧ��Ҫ�ڱ�ԡ�½��У�ԭ����__________________
��4�������˵õ��İ�ɫ�ᾧ����ʹ������ˮ���Ҵ�ϴ�ӣ�ʹ���Ҵ�ϴ�ӵ�Ŀ����______________.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com