
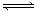 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)| 实验序号 | 温度0C | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
 。
。 ,解得x=0.6,即转化率是60%。
,解得x=0.6,即转化率是60%。 <1,所以反应向正反应方向移动。
<1,所以反应向正反应方向移动。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
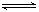 2C(g),若经2秒后测得C的浓度为0.6 mo1·L-1,现有下列几种说法:
2C(g),若经2秒后测得C的浓度为0.6 mo1·L-1,现有下列几种说法:| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
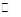 2C(g),现等物质的量的投料反应物A、B于恒温恒容体系I和恒温、恒压体系II中,达平衡时体系I中A的物质的量浓度为M,体系II中A的物质的量浓度为m,则M与m的关系为
2C(g),现等物质的量的投料反应物A、B于恒温恒容体系I和恒温、恒压体系II中,达平衡时体系I中A的物质的量浓度为M,体系II中A的物质的量浓度为m,则M与m的关系为查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 C(g)
C(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3
2NH3 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ; 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的
2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的| A.正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 |
| B.正反应速率减慢,逆反应速率加快,平衡向逆反应方向移动 |
| C.正逆反应速率均加快,平衡不移动 |
| D.正逆反应速率均减慢,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.反应的化学方程式为:N 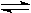 2M 2M |
| B.t2时,反应不再发生 |
| C.t2时,正反应速率等于逆反应速率 |
| D.t3后,反应到达最大限度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
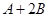
 C分别在三种不同实验条件下进行,它们的起始状态均为
C分别在三种不同实验条件下进行,它们的起始状态均为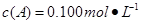 、
、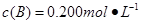 、
、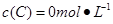 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是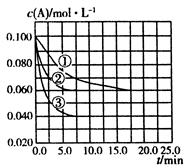
| A.反应的平衡常数:①<② |
B.反应A+2B C的 C的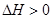 |
| C.实验②平衡时B的转化率为60% |
D.实验③平衡时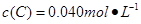 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com