
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
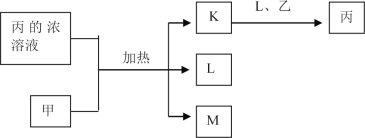
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质之间不可能实现如图所示转化的是( )
![]()
选项 | X | Y | Z | M |
A | S | SO2 | SO3 | O2 |
B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
C | NaOH | Na2CO3 | Na2CO3 | CO2 |
D | HN3 | NO | NO2 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量。
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4。
已知:a.CaO(s)+CO2(g)=CaCO3(s) ΔH= -178.3 kJ·mol-1;
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH= -2762.2 kJ·mol-1 ;
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH= -2314.8 kJ·mol-1 。
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:______。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() =1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
(2)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,反应为COS(g)+H2(g)H2S(g)+CO(g) ΔH>0。
①恒温、恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2mol H-S键的同时形成1 mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到平衡:H2S(g)+CO(g)COS(g)+H2(g) K=0.25。则该温度下反应COS(g)+H2(g) H2S(g)+CO(g)的平衡常数K'=__。
③T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1mol H2(g),达到平衡时COS的转化率为____。(计算结果保留到小数点后一位)
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为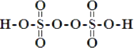 。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应,反应过程如下:
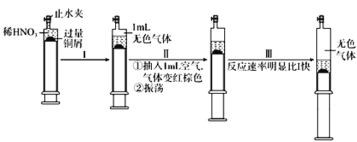
下列说法错误的是
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
B.步骤III反应速率比I 快的原因一定是NO2溶于水,使c(HNO3)增大
C.过程Ⅱ中气体变成红棕色的反应为2NO+O2=2NO2
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、X均为中学化学常见物质,一定条件下它们有如右图所示转化关系(其它产物已略去),下列说法错误的是( )

A. 若A为AlCl3,则X可能为KOH溶液 B. 若X为O2,A可能是C
C. 若A是强碱,则C可能是酸式盐 D. A也有可能是Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。

已知:①![]()
②![]()
③![]()
请回答下列问题:
(1)下列有关F的说法正确的是_________。
A.分子式是![]() B.F即能与HCl又能与
B.F即能与HCl又能与![]() 反应生成盐
反应生成盐
C.能发生取代反应和缩聚反应 D.![]() 的F最多可以和
的F最多可以和![]() 反应
反应
(2)C→D的反应类型是________。
(3)在合成F的过程中,B→C步骤不能省略,理由是______________。
(4)D→E反应所需试剂是____________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)____。
①苯环上只有两种不同化学环境的氢原子②分子中含有![]()
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。_______________注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
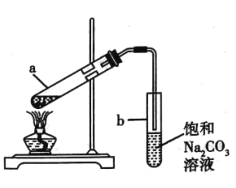
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com