
【题目】如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
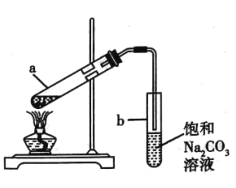
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
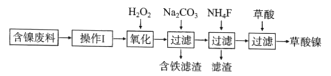
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
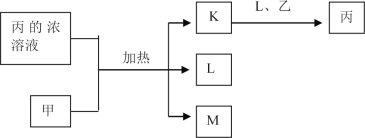
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为_________。
(2)可以区别甲烷和乙烯的试剂是_________(填正确选项的编号)。
A.浓硫酸 B.碳酸钠溶液 C.溴的四氯化碳溶液 D.酸性高锰酸钾溶液
(3)CH3CH3可以通过乙烯和_________反应生成。
(4)已知 2CH3CHO+ O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下所示:
反应②的化学方程式为______________________。
工业上以乙烯为原料生产聚乙烯的化学方程式为_________,反应类型属于_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制备金属铝的主要原料,其主要成分是Al2O3,同时还含有SiO2 和Fe2O3。工业上可使用碱浸法提取铝土矿中的 Al2O3,其工业流程如图所示。根据图示信息,回答下列问题。
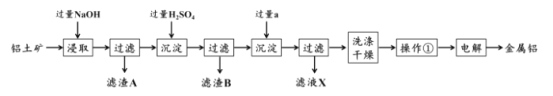
(1)为了提高铝土矿的浸取效率,可采用的方法是:______。
(2)第一次沉淀时发生了一系列离子反应,除了生成固体 B 的反应外,还有另外两个反应,请分别写出它们的离子方程式:_______,______。
(3)液体试剂 a 的化学式为_________。
(4)该工艺的副产品存在于滤液 X 中,除 Na2SO4 外,其主要成分是________ (填化学式)。试列举一项该副产品在工业生产或日常生活中的用途:________。
(5)操作①的名称为____。若在实验室中进行该操作,样品应放置在_______中。
(6)最后一步电解时往往需要加入适量冰晶石,其作用是 __________。
(7)取 10.0 g 铝土矿按照上述工艺进行处理,并在工艺中使用 5.0 mol/L 的稀硫酸。第一次沉淀时所得沉淀的质量与加入硫酸的体积变化关系如图所示。则该铝土矿样品中 Al2O3 的质量分数为 ________。
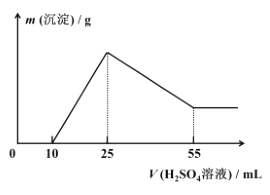
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,该晶体中原子之间的作用力是_____________。
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为______.

(3)立方BP(磷化硼)的晶胞结构如图所示,晶胞中含B原子数目为_____________ 。
(4)科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示。该化合物中的K原子和C60分子的个数比为_____________________ 。


(5)铁有γ、δ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氨水中通入少量二氧化硫:NH3H2O+SO2═NH4++HSO3-
B. 向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. 电解氯化镁溶液:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
D. 氢氧化钡溶液中滴入硫酸氢钠溶液至Ba2+恰好完全沉淀:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
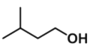
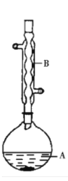
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室可利用乙酸与异戊醇在浓硫酸催化下加热反应制备乙酸异戊酯。实验装置示意图和有关数据如下,本实验采用环己烷作为溶剂。
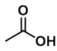 +
+
![]()
 +H2O
+H2O
物质 | 摩尔质量(g/mol) | 密度(g/mL) | 沸点(℃) | 水中的溶解性 |
异戊醇 | 88 | 0.81 | 131 | 微溶 |
乙酸 | 60 | 1.05 | 118 | 可溶 |
乙酸异戊酯 | 130 | 0.80 | 142 | 难溶 |
环己烷 | 84 | 0.78 | 81 | 难溶 |
实验步骤:
①在A中加入 4.4 g 的异戊醇、6.0 g 的冰醋酸、1.0 mL 浓硫酸、25 mL 环己烷和搅拌磁子。在仪器A上方放置仪器B,保证磨口严密,并将整个装置固定。
②打开磁力搅拌并缓慢加热A,直到溶剂开始回流。保持此温度加热,维持体系回流 50 分钟。
③反应液冷至室温后倒入分液漏斗中,用25mL水洗一次,再用5%碳酸氢钠溶液洗至中性。
④最后再用水洗涤有机层一次,分出的产物加入少量无水硫酸镁固体,静置片刻。
⑤过滤除去硫酸镁固体,进行蒸馏纯化,收集合适馏分,得乙酸异戊酯 3.51 g。
(1)仪器B 的名称为_____________。
(2)步骤②中,在“打开磁力搅拌并缓慢加热A”前,遗漏了一个重要操作。此疏漏可造成整个实验失败并引起火灾风险。此遗漏的操作为 _______________________。
(4)步骤⑤中通过蒸馏获得最终产品时,实验者应在_________℃ 左右收集产品。通过计算,本实验的产率是_____________。
(5)在真实的合成实验中,往往会在装置 A 与装置 B 之间添加一个分水器(如图)。其基本工作原理是:溶剂环己烷和反应中生成的水形成二元共沸物,沸腾时二者共同蒸出,经冷凝后落入分水器中。此时分水器中液体也会分层,被带出的水分处于_________层(选填上或下)。由上述工作原理可知,分水器在此实验中最大的作用是________。分水器的另一重要用途是观察和控制反应进度。假设本实验产率达到 100%,且反应生成的水被全部蒸出并完全冷凝,则分水器中可分离得到的水的体积为_____mL。(水的密度取1.00 g/mL,不考虑浓硫酸中的水分)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O],其相对分子质量为392,在空气中不易被氧化,易溶于水,不溶于乙醇,100℃时易失去结晶水。现用FeSO4溶液与(NH4)2SO4反应,制取硫酸亚铁铵晶体,其流程如图所示:

(1)“混合反应”时温度需控制在70~80℃,可采取的措施是___________,该过程中乙醇的作用是___________。
(2)现对制得的硫酸亚铁铵晶体进行纯度测定:准确称取4.000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.100mol·L-1标准KMnO4溶液进行反应,当![]() 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00mL。
已知:![]() +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①若用稀盐酸替代稀硫酸进行酸化,则实际消耗的标准KMnO4溶液的体积___________20.00mL。(填“大于”或“小于”或“等于”)
②试通过计算,求该硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的纯度(写出计算过程)___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com