
【题目】(1) 一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,该晶体中原子之间的作用力是_____________。
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为______.

(3)立方BP(磷化硼)的晶胞结构如图所示,晶胞中含B原子数目为_____________ 。
(4)科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示。该化合物中的K原子和C60分子的个数比为_____________________ 。


(5)铁有γ、δ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为__________。

【答案】3:1 金属键 Cu3AuH8 4 3∶1 4 4∶3
【解析】
(1)根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
(2)CaF2的结构如图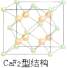 ,利用均摊法计算;
,利用均摊法计算;
(3)根据均摊法计算;
(4)根据均摊法计算晶胞中K原子、C60分子数目,确定数目之比;
(5)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值。
(1)铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×![]() =3,晶胞中Au原子数目=8×
=3,晶胞中Au原子数目=8×![]() =1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
=1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
(2)CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
(3)晶胞中B原子位于顶点和面心,数目为8×![]() +6×
+6×![]() =4;
=4;
(4)晶胞中K原子数目=2×6×![]() =6、C60分子数目=1+8×
=6、C60分子数目=1+8×![]() =2,故晶胞中K原子、C60分子数目之比=6:2=3:1;
=2,故晶胞中K原子、C60分子数目之比=6:2=3:1;
(5)γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图三条曲线表示 C、Si 和 P 元素的前四级电离能变化趋势。下列说法正确的是

A. 元素电负性:c>b>aB. 最简单氢化物的稳定性:c>a>b
C. 最简单氢化物的相对分子质量:a>b>cD. 第五电离能 I5:a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、X均为中学化学常见物质,一定条件下它们有如右图所示转化关系(其它产物已略去),下列说法错误的是( )

A. 若A为AlCl3,则X可能为KOH溶液 B. 若X为O2,A可能是C
C. 若A是强碱,则C可能是酸式盐 D. A也有可能是Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
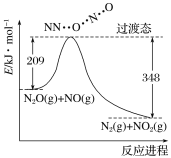
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
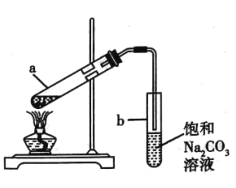
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )

A.若a=4,则A是强酸,B是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.稀释前两种酸溶液的浓度:c(A)>c(B)
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应 2NaCl(s) = 2Na(s)+Cl2(g)的 △H>0, △S>0
B. 常温下,将稀CH3COONa溶液加水稀释后,恢复至原温度,pH增大和Kw不变
C. 合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
D. 氢氧燃料电池工作时,若消耗标准状况下11.2LH2,则转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com