
(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题: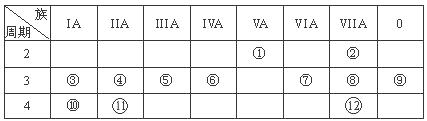
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~?元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
(1)① N,⑥Si,⑦S。 (2)④  ⑧
⑧ 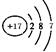
(3)K、F、Ar。 (4)Cl,b, (5)Na, Cl,
解析试题分析:根据元素在周期表中的位置可确定:① 是N,②是F;③是Na;④是Mg;⑤是Al;⑥是Si,⑦是S。⑧是Cl;⑨是Ar;⑩是K;(1)写出下列元素符号:①N,⑥Si,⑦S。(2)画出原子的结构示意图:④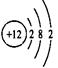 ,⑧
,⑧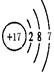 ;(3)在同一周期中元素的金属性随原子序数的增大而逐渐减弱,在同一主族中随原子核外电子层数的增大,元素的金属性逐渐增强,所以在①~?元素中,金属性最强的元素是K。(4)元素⑦与元素⑧相比,非金属性较强的是Cl,能证明这一事实的是 ⑧的氢化物比⑦的氢化物稳定,与常温下⑦的单质和⑧的单质状态不同及是否一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应无关,因此选项是b。(5)由于同一周期的元素的原子半径随原子序数的增大而减小,所以第三周期中原子半径最大的元素是Na,跟它同周期的ⅦA元素是Cl。
;(3)在同一周期中元素的金属性随原子序数的增大而逐渐减弱,在同一主族中随原子核外电子层数的增大,元素的金属性逐渐增强,所以在①~?元素中,金属性最强的元素是K。(4)元素⑦与元素⑧相比,非金属性较强的是Cl,能证明这一事实的是 ⑧的氢化物比⑦的氢化物稳定,与常温下⑦的单质和⑧的单质状态不同及是否一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应无关,因此选项是b。(5)由于同一周期的元素的原子半径随原子序数的增大而减小,所以第三周期中原子半径最大的元素是Na,跟它同周期的ⅦA元素是Cl。
考点:考查元素周期表、元素周期律的应用的知识。


科目:高中化学 来源: 题型:单选题
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是: HXO4 >H2YO4 >H3ZO4,则下列判断错误的是
| A.原子半径:X > Y > Z | B.气态氢化物的稳定性:HX > H2Y > ZH3 |
| C.非金属性:X > Y > Z | D.阴离子的还原性:Z3- > Y2- > X- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
超铀元素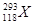 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子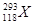 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | | | |||||||||||||||
| | | | | f | | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | | d | | | | | g | | | k | |
| | | | | | | | | | | | | | | | | l | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸。请根据以上信息回答下列问题。
(1)F元素在元素周期表中的位置是______________。
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:______________。
(3)A2C2可以制备C2,该反应的化学方程式是______________。
(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是___________。
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A | | | |||||||||||||||
| | | | | | E | | G | | |||||||||
| B | C | D | | | F | H | | ||||||||||
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气 的速率变化情况如图所示图中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。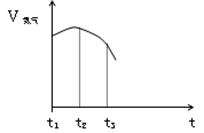
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核 外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为 ;②乙元素在周期表中的位置为 ;③丙元素的最高价氧化物的电子式为 ;④甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com