
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A | | | |||||||||||||||
| | | | | | E | | G | | |||||||||
| B | C | D | | | F | H | | ||||||||||
| | | | | | | | | | | | | | | | | | |
(1)第三(或3) 第ⅥA (2)Na HF ;(3)Al2O3 ;NaOH ;HClO4;
(4)离子 
解析试题分析:根据题意可知:A是H;B的Na;C是Mg;D的Al;E的N;F是S;G是F;H是Cl。(1)F元素处于周期表中第三周期第ⅥA 。(2)由于同一周期的元素随着原子序数的增大,原子半径逐渐减小,同一主族的元素,随着原子核外电子层数的增多,原子半径逐渐增大,所以原子半径最大的是Na;元素的非金属性越强,元素形成的氢的化合物稳定性就越强,所以在E、F、G、H元素中非金属性最强的是F,所以F形成的化合物HF最稳定。(3)最高价氧化物是两性氧化物的是Al2O3 ;元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,元素的金属性最强的是Na;所以元素的最高价氧化物对应的水化物碱性最强的是NaOH;元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,除F、O不能形成含氧酸外,非金属元素形成的最高价氧化物对应水化物的酸性最强的是HClO4;(4)C与H形成的化合物MgS中含有离子键;其形成过程用电子式表示是: 。
。
考点:考查元素的推断、元素的原子、形成的化合物的性质及物质的电子式表示的知识。


科目:高中化学 来源: 题型:单选题
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
| A.热稳定性:H2Y<HZ | B.原子半径:W>X>Z>Y |
| C.离子半径:W2+>Y2- | D.碱性:XOH<W(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题: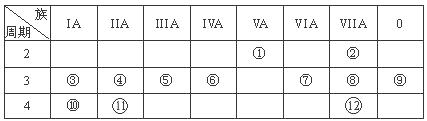
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~?元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑩ |
| 4 | | | | | | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为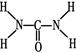 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列各个曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中: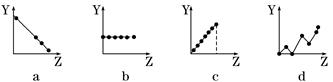
(1)ⅡA族元素的最外层电子数________;
(2)第3周期元素的最高化合价________;
(3)F-、Na+、Mg2+、Al3+的离子半径________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称___ _____;B在周期表中的位置第 ______周期,第________族;
(2)A、B形成的化合物的电子式____ ____;
(3)C的元素符号________,C的最高价氧化物的化学式____ ____;
(4) D的最高价氧化物对应的水化物的化学式____ ____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com