
(7分)氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为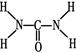 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。
(1) (2分)(2)sp2(1分)sp3(1分)
(2分)(2)sp2(1分)sp3(1分)
(3)①三角锥形(1分)②3(2分)
解析试题分析:(1)氮元素的核外电子数是7个,则根据核外电子排布规律可知基态氮原子的价电子轨道表示式是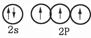 。
。
(2)根据尿素的结构简式可知,分子中氮元素全部形成单键,因此是sp3杂化;碳元素形成2个单键,1个双键,因此是sp2杂化。
(3)①氨气分子中氮原子的价层电子对数=4,其中有一对孤对电子,所以氨气是三角锥形。
②当肼燃烧放出519.35kJ热量时,根据热化学方程式可知生成氮气的物质的量是 ×3=1.5mol。氮气分子中含有2个π键,则π键的物质的量是3mol。
×3=1.5mol。氮气分子中含有2个π键,则π键的物质的量是3mol。
考点:考查核外电子排布、杂化轨道、反应热以及共价键计算等


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:单选题
下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A.光气(COCl2) | B.六氟化硫(SF6) |
| C.三氟化硼(BF3) | D.五氯化磷(PCl5) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | | | |||||||||||||||
| | | | | f | | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | | d | | | | | g | | | k | |
| | | | | | | | | | | | | | | | | l | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A | | | |||||||||||||||
| | | | | | E | | G | | |||||||||
| B | C | D | | | F | H | | ||||||||||
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)下表是元素周期表短周期的一部分
| ① | | | ||||||
| | | | | ② | ③ | | ④ | |
| | ⑤ | ⑥ | ⑦ | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气 的速率变化情况如图所示图中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。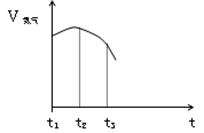
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核 外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为 ;②乙元素在周期表中的位置为 ;③丙元素的最高价氧化物的电子式为 ;④甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:l,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)写出下列元素的名称:B______ C_____ E_______
(2)F在元素周朔表的位置是_________,与F同周期且未成对电子数最多的元素为______(填写元素符号),该元素基态原子的核外电子电子排布式为__________;
(3)B与D组成的化合物可以与水反应,写出它与水反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com