
【题目】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。納米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
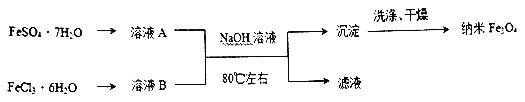
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是_______(填化学式),该物质的用途是___________(任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___________ 。
(3)证明沉淀已经洗涤干净的操作是___________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是___________。
II.制备纳米四氧化三铁的另一种流程如下图所示。
![]()
(6)写出第2 步反应的化学方程式______________,其中氧化产物和还原产物的物质的量之比为______。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________。
【答案】 Fe2O3 红色油漆、涂料、炼铁 加盐酸 少量最后一次洗涤液于试管中,加盐酸酸化,滴加氯化钡溶液,不产生白色沉淀 Fe2++2Fe3++8OH-![]() Fe3O4+4H2O 反应过程中部分亚铁离子被氧气氧化为铁离子 6FeOOH+CO=2Fe3O4+CO2+3H2O 1:2 胶体
Fe3O4+4H2O 反应过程中部分亚铁离子被氧气氧化为铁离子 6FeOOH+CO=2Fe3O4+CO2+3H2O 1:2 胶体
【解析】(1)FeO(氧化亚铁) FeO是一种 黑色粉末,不稳定,在空气里受热,就迅速被氧化成 Fe3O4,除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是Fe2O3,Fe2O3用途是红色油漆、涂料、炼铁;(2)实验室保存溶液BFeCl3时为了防止水解出现浑浊,通常采用的措施是加盐酸抑制FeCl3水解生成Fe(OH)3沉淀。(3)证明沉淀已经洗涤干净,只要检验洗涤液中是否含硫酸根离子,操作是少量最后一次洗涤液于试管中,加盐酸酸化,滴加氯化钡溶液,不产生白色沉淀;(4)该方法中发生的主要反应的离子方程式Fe2++2Fe3++8OH-![]() Fe3O4+4H2O ;(5)实际生产中为提高产率,起始所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1:2,原因是反应过程中部分亚铁离子被氧气氧化为铁离子;(6)第2步反应FeOOH吸收CO,生成Fe3O4,化学方程式:6FeOOH+CO=2Fe3O4+CO2+3H2O ;其中氧化产物为CO2和还原产物Fe3O4的物质的量之比等于方程式中的计量数之比,为1:2;(7)纳米四氧化三铁的粒子大小在1纳米和100纳米之间纳米,Fe3O4投入分散剂中形成的分散系是胶体。
Fe3O4+4H2O ;(5)实际生产中为提高产率,起始所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1:2,原因是反应过程中部分亚铁离子被氧气氧化为铁离子;(6)第2步反应FeOOH吸收CO,生成Fe3O4,化学方程式:6FeOOH+CO=2Fe3O4+CO2+3H2O ;其中氧化产物为CO2和还原产物Fe3O4的物质的量之比等于方程式中的计量数之比,为1:2;(7)纳米四氧化三铁的粒子大小在1纳米和100纳米之间纳米,Fe3O4投入分散剂中形成的分散系是胶体。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。其部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
回答下列问题:
Ⅰ.实验室合成硫酰氯要先制取干燥氯气。制备干燥纯净的氯气所用仪器如下图:

(1)圆底烧瓶中发生的离子反应方程式为_____________。
(2)上述仪器的连接顺序是:e接 , 接 , 接 , 接 (按气流方向,用小写字母表示)。______________________
II.催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):

(3)仪器B冷却水的进口为________(填“a””或“b”),活性炭的作用是________。
(4)装置D除干燥气体外,另一作用是_______________。若缺少D,则硫酰氯会水解,该反应的化学方程式为________________。
(5)某同学建议将收集器A放在冰水中冷却,你认为该同学的建议是否合理,为什么? _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是____________。
(2)有浓度均为0.2 mol·L-1的Na2CO3溶液与NaHCO3溶液,试回答下列问题:
①微粒种类:Na2CO3__________NaHCO3溶液(填“﹥”、“<”或“=”)。
②两溶液分别加入0.1 molNaOH固体,恢复到室温,Na2CO3溶液中的c(CO32-)____________(填“增大”、“减小”或“不变”);NaHCO3溶液中的c(HCO3-)_________(填“增大”、“减小”或“不变”)。
(3)常温下,甲为0.1 mol·L-1的HA溶液,pH﹥1;乙为0.1 mol·L-1的BOH溶液,且溶液中c(OH-):c(H+)=1012。请分别写出甲、乙两溶液中溶质的电离方程式:
甲__________________、乙_________________。
(4)相同条件下,对于浓度均为0.1 mol·L-1的NaCl溶液和CH3COONa溶液,溶液中的离子总数:NaCl溶液__________CH3COONa溶液(填“﹥”、“<”或“=”)。
(5)物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵五种溶液中c(NH4+)由大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是
A. Na、K、Cl、S、O
B. F、I、Fe、Zn、Cu
C. N、H、O、P、C
D. Ge、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 对氧化铁和碳的混合物高温加热
B. 石英、纯碱、石灰石的混合物高温制玻璃
C. 将铜丝烧红并迅速插入乙醇中充分反应
D. 将锌粒投入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Cu2+、K+、Cl-、NO3- B. Ag+、Na+、Cl-、NO3-
C. Mg2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、 Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
溶解度/(g/100 g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为________________________________________,
电池反应的离子方式为________________________________________。
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌________g。(已知F=96 500 C·mol-1)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过________分离回收;滤渣的主要成分是MnO2、________和________,欲从中得到较纯的MnO2,最简便的方法为________,其原理是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com